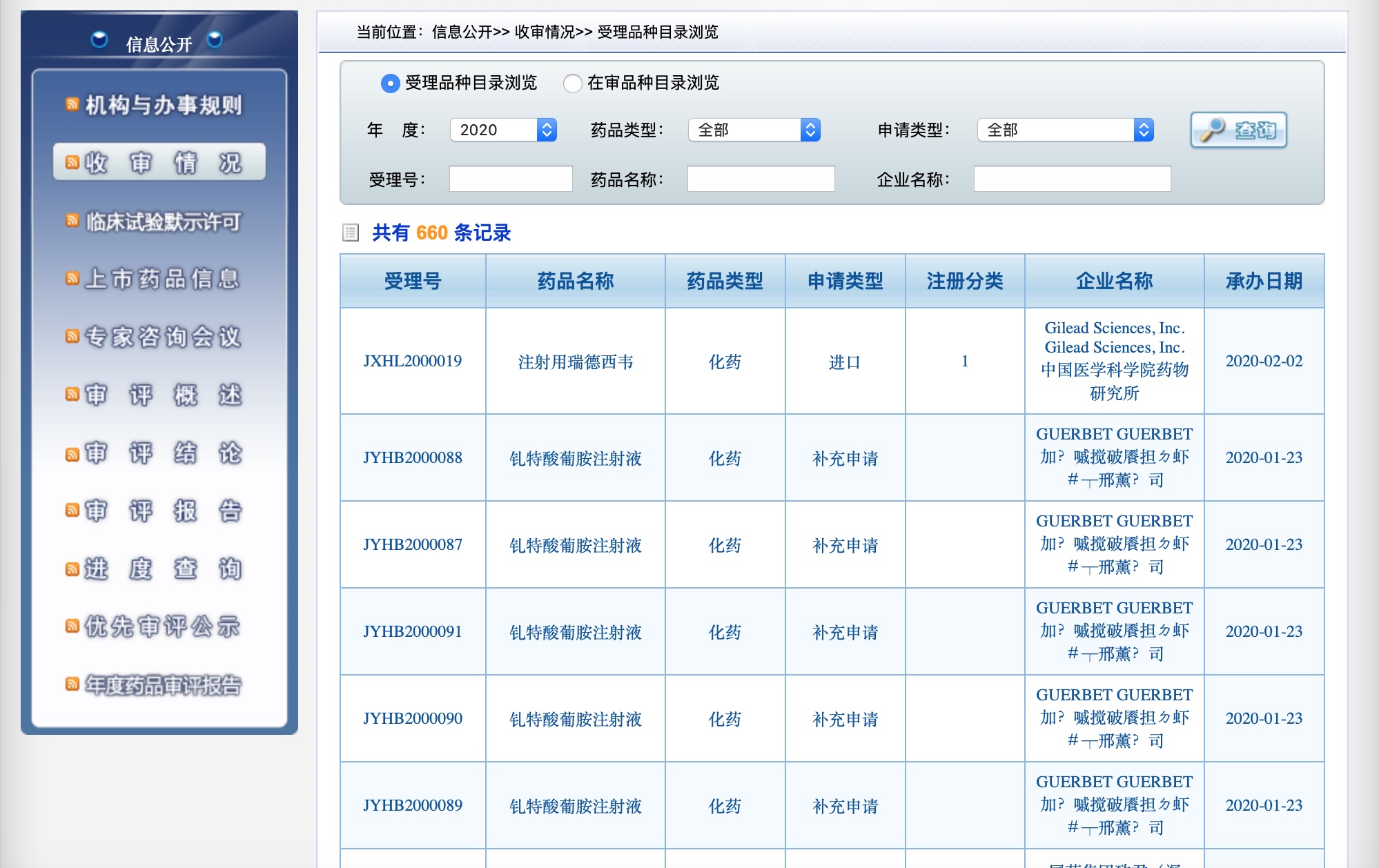
新冠肺炎潜在有效药瑞德西韦临床试验申请获中国药监部门受理
2月2日上午,国家药监局药品评审中心(CDE)网站显示,新型冠状病毒感染肺炎的潜在有效药物瑞德西韦(remdesivir)临床试验申请已经获受理。受理文件显示,注册企业为吉利德科学与中国医学科学院药物研究所。
据澎湃新闻此前从该药物的研发公司吉利德获知的消息,瑞德西韦治疗新型冠状病毒(2019-nCoV)肺炎的临床试验,将于2月3日在中国启动。
据悉,吉利德将配合中国的卫生部门开展一项随机、对照试验,以确定使用Remdesivir治疗2019-nCoV感染者是否安全和有效。
Remdesivir是一种核苷酸类似物前药,能够抑制依赖RNA的RNA合成酶(RdRp)。这款在研药物原本是针对埃博拉病毒研发的,刚刚在美国的一起案例中被证明对新型冠状病毒感染的肺炎有效。
国家药审中心网站披露的工作流程显示,一般药物的临床试验申请审评时间为60日,而瑞德西韦的注册申请被火速受理也体现了我国新药审评审批制度中特事特办的原则。
北京时间2月1日,吉利德科学全球首席医疗官Merdad Parsey博士代表公司发布声明,公司正与全球卫生机构密切合作,提供在研药物瑞德西韦用于试验性治疗,以支持应对新型冠状病毒(2019-nCoV)感染的爆发。
美国首例“新冠”患者治疗后大幅好转,中国火速受理临床试验申请
新型肺炎疫情的蔓延令人揪心。昨天,新英格兰医学杂志(NEJM)传来好消息,美国第一例新型冠状病毒(2019-nCoV)的肺炎患者经过一种尚处于临床试验阶段的新药治疗后,病情迅速出现了好转。
图片来源 / 图虫创意
来源:21世纪经济报道 记者:卢杉编辑:李清宇、苏敏华
美国首例“新冠”患者治疗后大幅好转
1月31日,顶尖医学期刊《新英格兰医学杂志》(NEJM)在线发表了一篇关于美国首例新型冠状病毒(2019-nCoV)确诊病例的论文,详细介绍了该患者就医、治疗以及临床表现。
其中最引人注意的是,这名患者在接受了一种叫做remdesivir的抗病毒药物治疗后,出现了大幅改善,“截至1月30日,患者仍在住院,但除了咳嗽,其他症状都好了,而且咳嗽的严重程度在减轻。”

该论文作者包括流行病情报局(MLH),国家免疫与呼吸疾病中心(AC,LF,AP)病毒疾病司,亚特兰大疾病控制与预防中心的流感处(TMU)和准备和新发感染处(SKP);华盛顿州卫生部等。
以下为论文的一些关键内容:
我们报告了在美国确认的首例2019-nCoV感染病例,并描述了该病例的鉴定、诊断、临床过程和管理,包括患者在病情第9天出现肺炎时的最初轻度症状。该案例强调了临床医生与地方、州和联邦各级公共卫生当局之间密切协作的重要性,以及需要迅速传播与这种新发感染患者的护理有关的临床信息的需求。
2019年12月31日,中国报告了与湖北省武汉市华南海鲜批发市场有关的人群中的肺炎病例。2020年1月7日,中国卫生当局确认与新型冠状病毒2019-nCoV有关。尽管最初报道的病例与武汉市海鲜市场的暴露有关,但当前的流行病学数据表明,正在发生人际传播。截至2020年1月30日,在至少21个国家/地区报告了9976例病例,包括2020年1月20日报道的美国首例确诊的2019-nCoV感染病例。
案例报告
2020年1月19日,一名35岁的男子出现在华盛顿州斯诺霍米什县的一家急诊诊所,有4天的咳嗽和主观发烧史。病人到诊所检查时,在候诊室戴上口罩。等待大约20分钟后,他被带到检查室接受了检测。他透露,他在中国武汉探望家人后于1月15日返回华盛顿州。该患者表示,他已经从美国疾病控制与预防中心(CDC)收到有关中国新型冠状病毒暴发的健康警报,由于他的症状和最近的旅行,他决定去看医生。
2020年1月19日(疾病第4天)的后前胸和外侧胸片。
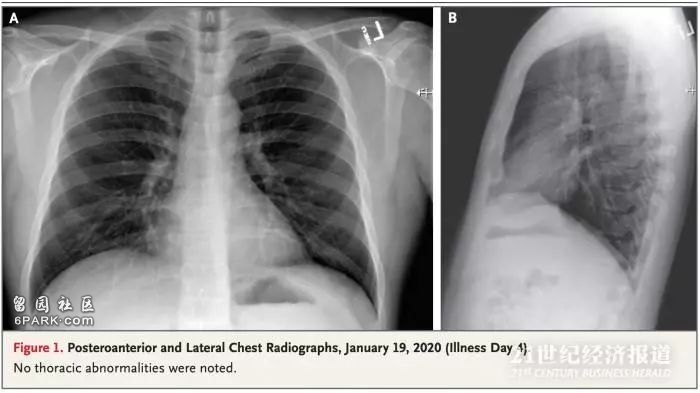
除了有高甘油三酸酯血症的病史外,该患者是不吸烟的健康人群。患者体温为37.2°C,血压为134/87 mm Hg,脉搏为每分钟110次,呼吸频率为每分钟16次,氧饱和度为96%。肺部听诊显示有支气管炎,并进行了胸片检查,未显示异常。
检测获得了鼻咽拭子标本,将其送去检测病毒性呼吸道病原体。在48小时内对所有测试的病原体均呈阴性,包括甲型和乙型流感,副流感,呼吸道合胞病毒,鼻病毒,腺病毒和已知会导致人类疾病的四种常见冠状病毒株(HKU1,NL63、229E和OC43)。
患者说他没有到过华南海鲜市场,但疾控中心认为有必要对患者进行2019-nCoV测试。根据CDC指南收集了8个标本,包括血清、鼻咽和口咽拭子标本。标本采集后,患者被送往家庭隔离,并由当地卫生部门进行监测。
1月20日,美国疾病预防控制中心(CDC)证实,该患者的鼻咽和口咽拭子通过实时逆转录酶-聚合酶链反应(rRT-PCR)检测为2019-nCoV阳性。患者被送往医疗中心隔离病房进行临床观察。
入院时,患者持续咳嗽,并有2天的恶心和呕吐史,没有呼吸急促或胸痛。生命体征在正常范围内。患者接受了支持治疗,包括2升生理盐水和恩丹西酮以缓解恶心。
在住院的第2至5天(患病的第6至9天),患者的生命体征基本保持稳定,除了出现间歇性发烧并伴有心动过速。咳嗽,并出现疲倦。在医院第二天的下午,患者排便不畅,腹部不适。收集其粪便的样品测试,以及其他呼吸道标本和血清。粪便和两个呼吸道标本随后均通过rRT-PCR检测为2019-nCoV阳性,而血清仍为阴性。
在此期间的治疗在很大程度上是支持性的。为了进行症状处理,患者需要根据需要接受解热疗法,该疗法包括每4小时650 mg对乙酰氨基酚和每6小时600 mg布洛芬。在住院的前六天,他还因持续咳嗽而服用了600毫克愈创甘油醚和约6升生理盐水。
患者从在医院第3天开始可以进行全血细胞计数和血清化学研究。有白细胞减少症,轻度血小板减少症和肌酸激酶水平升高,肝功能指标也有所变化。
但是从入院第5天晚上(患病第9天)晚上进行的第二次胸部X光片检查显示,左肺下叶有肺炎。这些影像学发现与从医院第5天晚上开始的呼吸状态变化相吻合,当时患者在呼吸周围空气时通过脉搏血氧饱和度测定的血氧饱和度值降至90%。在第6天,患者开始吸氧,并使用万古霉素和头孢吡肟治疗。
在医院第6天(患病第10天),第四次胸部X射线照片显示两个肺中都有基底条状混浊,患者持续发烧,多个部位持续阳性,严重肺炎。
于是,在入院的第7天,医生开始使用了一种尚在研发阶段的抗病毒药物进行静脉注射,未观察到与输注有关的不良事件。并停用万古霉素和头孢吡肟。
紧接着转折来了,第8天,患者的临床状况得到改善。并停止吸氧,氧饱和度值提高到94%至96%。先前的双侧下叶罗音不再存在。他的食欲得到改善,除了间歇性干咳和鼻涕外,没有其他症状。截至2020年1月30日,患者仍住院。他已经不再发热,除咳嗽外,所有症状均已缓解,咳嗽的程度正在减轻。

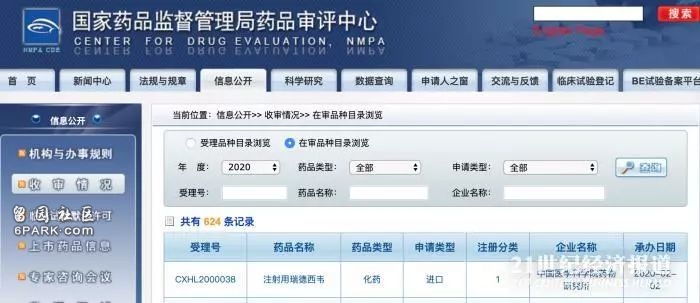
好消息!国家药审中心火速受理“新冠”药物remdesivir临床试验申请
2月2日,据国家药品监督管理局药品评审中心(CDE),一项针对新型冠状病毒肺炎的药物瑞德西韦remdesivir的临床试验申请已获受理。
remdesivir此前是吉利德公司针对埃博拉病毒开发的一种药物,在全球均未上市,不能随便使用,要经过严格的临床试验才能验证其在新型冠状病毒的安全性和有效性。
1月31日,吉利德科学公司首席医学官医学博士Merdad Parsey表示:“吉利德正在与全球卫生当局密切合作,通过适当地、实验性使用我们的研究化合物remdesivir来应对新型冠状病毒(2019-nCoV)的爆发。”
他提到的机构包括美国食品药品监督管理局(FDA)、美国疾病控制中心(CDC)、美国卫生与公共服务部(DHHS),中国疾病预防控制中心和国家药品监督管理局(NMPA),美国国家过敏与传染病研究所(NIAID),以及个人研究人员和临床医生等。
吉利德同时声明:Remdesivir尚未在全球任何地方获得许可或批准,并且尚未证明对任何用途都是安全或有效的。应主治医师的要求,并在当地监管机构的支持下(权衡了在2019-nCoV中提供无数据的实验药物的风险和收益),吉利德提供了Remdesivir用于少数新型冠状病毒患者在没有任何批准的治疗方案的情况下,用于紧急治疗。
吉利德正在与中国卫生部门合作建立一项随机对照试验,以确定Remdesivir是否可以安全有效地用于治疗2019-nCoV。我们还将加快针对2019-nCoV的Remdesivir的适当实验室测试。
“尽管目前尚无Remdesivir对2019-nCoV的抗病毒数据,但其他冠状病毒的可用数据给了我们希望。Remdesivir在动物模型中已证明其对病毒病原体MERS和SARS的体外和体内活性,这是与2019-nCoV结构相似的冠状病毒。紧急使用Remdesivir治疗埃博拉病毒感染患者的可用临床数据也有限。”
截至2月1日24时,国家卫生健康委收到31个省(自治区、直辖市)和新疆生产建设兵团累计报告确诊病例14380例(广东省核减1例),现有重症病例2110例,累计死亡病例304例,累计治愈出院病例328例,共有疑似病例19544例。

疫情依然严峻,希望制药产业界能尽快发现可以抑制2019-nCoV病毒的药物或预防感染的疫苗!
封面新闻记者 汤晨
1月31日,《新英格兰医学杂志》上发表的一篇报告称,一款名为remdesivir(瑞德西韦)的实验性药物被用于治疗华盛顿州的一名新冠肺炎感染的患者,初步见效。这名男子现年35岁,曾去过中国武汉,在返回美国后,他成为美国第一个确诊的新型冠状病毒的患者。
该报告称,治疗人员于1月26日给住院第7天的患者使用remdesivir(瑞德西韦),次日患者的临床情况有所改善。截至1月30日,患者仍在住院治疗,但研究人员写道,“除了咳嗽之外,所有症状都已得到缓解,咳嗽的严重程度正在减轻。”

《新英格兰医学杂志》论文截图
在接受remdesivir(瑞德西韦)药物治疗前,该患者的体温一度达到了39.4摄氏度。使用该药物后,第二天体温降至37.3摄氏度,随后几天降至正常范围。
“在接受治疗之前,他一直在发高烧,病情越来越严重,”病人在普罗维登斯地区医疗中心埃弗雷特的主治医生接受采访时说。“接受remdesivir(瑞德西韦)治疗后,他的发热症状减轻,不再需要吸氧。他的肺部CT明显更清晰了,患者的整体感觉好多了。”
记者从该医药公司官网获悉,remdesivir(瑞德西韦)尚未在全球任何地方获得许可或批准,也未被证明是安全或有效的任何用途。应治疗医师的要求,并在当地监管机构的支持下,该医药公司向一些病患提供了remdesivir(瑞德西韦),用于少数新型冠状肺炎患者进行紧急治疗。
吉利德医药公司官网的声明
此外,该医药公司官网的消息称,他们正与中国卫生当局洽谈有关合作。一旦达成合作,他们将在感染新型冠状病毒的患者身上进行remdesivir(瑞德西韦)的临床试验。该医药公司没有公布目前有多少患者服用了这种药物。
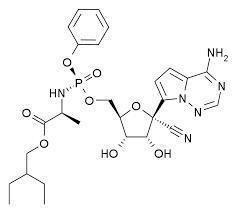
根据公开资料显示,remdesivir(瑞德西韦)最初是美国吉利德医药公司开发用来治疗埃博拉病毒的药物,在埃博拉患者的临床试验中,这种药物的效果不如其他治疗方法。但后来发现它对SARS、MERS等冠状病毒具有合理的抗病毒活性。
remdesivir(瑞德西韦)最初是为抗击埃博拉研发
美国已找出肺炎神药?患者晚上使用,次日退烧症状基本消失,中国患者能用上吗?
1月31号,权威医学期刊《新英格兰医学杂志》(NEJM)在线发表了多篇关于新型冠状病毒(2019-nCoV)病例的论文,其中一篇介绍了美国首例确诊病例的诊疗过程以及临床表现。
这篇论文引发了大众关注,因为有一种药物起到了立竿见影的疗效:病人于住院第7天晚上开始使用药物Remdesivir(雷德西韦),次日退烧(体温从头一天的39.4摄氏度降低到次日的37.3摄氏度),症状明显减轻!

美国首例新冠患者的病程
这篇论文显示的患者病程如下:
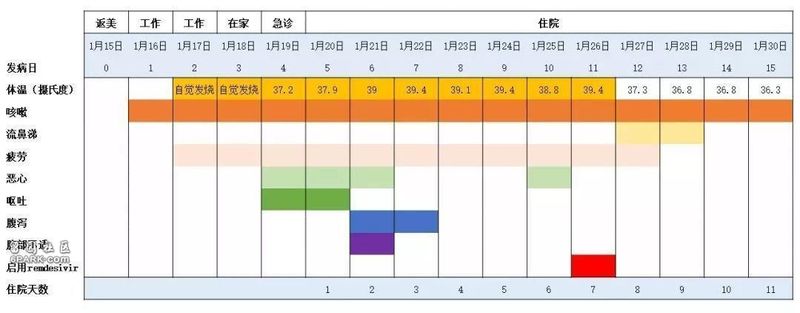
患者为35岁男性。
今年1月15日从武汉返回美国。1月16日开始咳嗽。1月19日前往一家急诊室求医。基于患者的武汉旅行史,美国CDC决定检测他是否携带新型冠状病毒,并要求他回家自我隔离。1月20日,该患者被确诊,检测出新型冠状病毒阳性,并被收治住院。
住院第五天,患者左肺下叶出现肺炎特征。同一天晚上,患者呼吸情况也有变化,氧饱和度下降到90%。医生们决定为他输氧,并使用万古霉素和头孢吡肟两种抗生素进行治疗。住院的第六天,这名患者的X光胸片结果显示出非典型性肺炎的特征。
基于患者的胸片结果,以及持续高烧,需要吸氧,且多个部位样本出现新型冠状病毒的阳性结果,医生们决定为其提供一种尚未获批的抗病毒药Remdesivir。
1月26日晚,患者接受了Remdesivir的静脉输注。次日,这名患者明显改善,退烧至37.3摄氏度,不再需要吸氧,氧饱和度也恢复到94%-96%。除干咳和流鼻涕外,已无其他症状。
同情用药,需更多临床验证
药物Remdesivir,是美国硅谷公司吉利德(Gilead)的一种在研新药。这是一种核苷酸类似物前药,能够抑制依赖RNA的RNA合成酶(RdRp)。该药在研发时原本计划用于埃博拉病毒治疗,但冠状病毒里同样有RdRp。因此,这种在研新药也有望对冠状病毒进行抑制。
在这个病例中,论文作者们认为这是基于患者恶化的病情,使用美国“同情用药”原则进行的治疗。尽管在治疗之后,患者病情出现迅速缓解,但我们依然需要进行随机对照的临床试验,来确定Remdesivir和其他在研药物在治疗新型冠状病毒感染上的安全性和有效性。
警惕新冠病毒的粪口传播
在论文的讨论环节,作者们指出在这名患者生病(并非住院)的第4天和第7天,病毒具有很高的载量水平,因此有传播的潜力。且患者粪便检测出现新型冠状病毒阳性,也值得注意。
传染病的传播方式有一种叫做粪口途径,也叫做经消化道传播。一些传染性疾病的病原体能够在大便之中存活,所以可以通过消化道排出的粪便进行传播,如果这些带病原体的大便,污染了手或者食物,那么就会病从口入,导致传染给其他人。新冠患者粪便中检测出病毒,说明我们需要警惕新冠病毒的粪口传播。
已和中国达成临床测试协议
1月27日,《科学》杂志曾发表一篇报道,《抗HIV组合或其他现有药物能战胜新冠状病毒吗?》,该文提出:Remdesivir的药物与单克隆抗体的组合很可能是新型冠状病毒2019-nCoV的理想疗法。
1月31日,吉利德发布了公司首席医学官Merdad Parsey博士针对2019新型冠状病毒(2019-nCoV)正在采取的药物研发行动的声明。
声明中称:“Remdesivir目前尚未在全球任何国家或地区获得批准,临床使用的安全性或有效性也尚未得到证明。但是为了响应临床医生的使用需求,以及支持部分药监机构的工作,我们已经慎重评估了提供这个未在2019-nCoV身上取得任何数据的在研药物的风险和获益。吉利德已经为少部分需要紧急救治但缺少治疗药物的患者提供了Remdesivir。”
今天,美国华尔街日报也报道称:吉利德(Gilead)公司已与中国正式达成协议,将对Remdesivir(雷德西韦)进行临床试验。

浙大教授:新冠病毒“特效药”瑞德西韦,别随便用
浙江大学教授王立铭在其微博发布了关于谨慎使用瑞德西韦的提醒长文。以下是其全文:
2020年2月1日,两条看起来毫不相关的新闻突然刷爆了社交网络。但挺巧合的是,两条新闻都涉及到新冠病毒肺炎的可能新疗法:
第一条来自《新英格兰医学杂志》。美国华盛顿州卫生局的一些科学家报道了他们如何治疗美国本土第一例新冠病毒肺炎患者。他们提到一种名叫瑞德西韦(remdesivir)的药物,在患者住院的第七天,医生们为他静脉注射了瑞德西韦,转天患者的情况就出现了好转:血氧浓度上升、肺部啰音消失、食欲也有所恢复。截至1/30日患者仍然在住院接受治疗,但是情况已经大大好转。(Holshue ML et al NEJM 2020)
第二条来自中国科学院。中科院上海药物所和武汉病毒所的科学家们联合发现,中成药双黄连口服液可抑制新型冠状病毒。根据报道,双黄连口服液已在上海公共卫生临床中心、华中科技大学附属同济医院开展临床研究。
双黄连这里压住不表,我们就来说说瑞德西韦。这是个什么药?到底有没有用?应该怎么用?
这是个什么药?
在前面的科普文里我讲到了一个药物研发应用的基本规律:在正式推广应用之前,一定要经历临床前研究-人体临床试验这两个根本无可替代的环节。
人体临床试验这个大家好理解,就是在大规模人群当中测试一种药物的安全性和有效性。理论上说,经过严肃设计和执行的大规模随机对照临床试验具有最高级别的可信度。简单来说就是招募合适的人,随机分成两组,一组服药,另一组使用安慰剂或标准治疗,然后在一段时间后比较服药组人群的疾病情况显著好于安慰剂组,并且副作用可以接受,那么我们就可以说这种药物真的管用。当然在现实情况中,特别是在临床需求特别急迫的时候(比如很多癌症晚期患者和传染病爆发期),人体临床试验的要求可以适当的有所放宽,这种情况大家也容易理解。
而所谓临床前研究,指的是在真正进入人体试验之前,所有在实验室里完成的必须研究工作,包括找到和完善候选的药物分子、在细胞和动物模型里做各种安全性和有效性的测试等等环节。只有在这个环节通过各种测试的药物分子,才能进入下一步,在人体上进行测试。这里头的道理很简单,咱们通俗点说,人命关天,咱们至少得大致确保一个东西无毒无害还有用,才能给人用、特别是病人用把?
带着这个基本的知识,我们再去看看瑞德西韦这种药物。
这种药物可不是为新冠病毒肺炎专门开发的新药——谁也做不到这么快开发一款新药。它是美国吉利德制药公司(Gilead)针对埃博拉病毒开发的一款药物。在临床前研究中,这款药物被发现能够抑制埃博拉病毒一个名叫RdRP的蛋白质——这个蛋白质对于埃博拉病毒在人体细胞内的复制繁殖至关重要(Tchesnokov EP et al Viruses 2019),因此能够起到很强的病毒抑制作用(McMullan LK et al Lancet 2019)。
但是,在2019年年底发表的一项大规模人体临床试验中,科学家们在刚果共和国的埃博拉疫情中测试了几种可能的药物,发现瑞德西韦的效果远不如另外两个单克隆抗体药物(REGN-EB3和MAb114)(Mulangu S et al NEJM 2019)。尽管从严格意义上说瑞德西韦仍然是一种尚在研究过程中的药物,但是它以埃博拉药物的身份获得上市批准已经是极其渺茫的一件事情。
但是这本身不意味着瑞德西韦的彻底死亡。
抗病毒药物有一个很有趣的特点,它们大多是针对病毒生存周期中至关重要的一些蛋白开发出来的,比如我们刚刚提到的这个RdRP蛋白(我们前面文章提到的克立芝针对的是艾滋病毒的蛋白酶,HIV-1 protease)。但是很多病毒的类似重要蛋白其实是非常相似的——这个倒是也不难理解,病毒这类简单生命能够玩出的花样其实很有限。
所以,一个针对病毒A设计出来的抗病毒药物,往往也能对不少类似的病毒BCD有疗效。比如我们提到过克立芝也许就能用来治疗本次的新冠病毒肺炎,在这里,瑞德西韦被用来治疗新冠病毒肺炎患者,也是类似的思路。虽然本职工作(对抗埃博拉病毒)不太到位,但是万一副业(对抗新冠病毒)能墙里开花墙外香呢?
但是请注意,有这种“墙里开花墙外香”的可能性,可不意味着我们就可以把瑞德西韦当成新冠病毒肺炎特效药,不意味着我们就应该立刻把它拿来给所有病人们用了!
这道理也很简单,虽然瑞德西韦已经完成了临床前研究和人体临床试验,但是可都是以抗埃博拉病毒药物的身份参与的。现在要把它用于一种全新的病毒和一种全新的疾病,就算此前的很多数据积累可以让我们大大加快其推进速度,该有的步骤仍然是必不可少的。
我们退一步说,即便考虑到瑞德西韦在此前的人体临床试验中看起来安全性还不错(Mulangu S et al NEJM 2019;但是你还是得考虑不同的患者群体副作用可能很不同),有些实验步骤可以直接跳过,那有一个步骤是绝对绝对不能跳过的:在大规模给患者使用之前,我们得至少证明它真的有用啊!
到底有没有用?
听到这里你可能有点糊涂了。
刚刚你并不还说美国人已经成功瑞德西韦治愈了一个新冠病毒肺炎的患者么?这不已经证明有效了么?
还真不能。
咱们再回顾一下瑞德西韦那条新闻:医生们给一位症状严重的新冠病毒肺炎患者使用了瑞德西韦,很快观察到了症状的缓解。
请注意,这个案例当然是非常激动人心的,但是它可不意味着这种药它就管用、或者它就适合大规模推广了。道理很简单,患者在住院治疗期间可不是只用了瑞德西韦这么一种药,你怎么排除其他治疗方法的作用?你怎么证明患者不是自己慢慢好起来的(特别考虑到新冠病毒肺炎确实存在相当大比例的自愈案例)?你怎么知道瑞德西韦这次“成功”不是运气使然,瞎猫碰到死耗子了?
类比一下,在前面的科普里我也提到北大第一医院王广发主任服用了抗艾滋病药物克立芝之后、自己的新冠病毒肺炎很快好转的故事。但是这个故事本身也不足以证明克立芝就适合立刻进入临床指南、大规模推广应用了。
在这两个药物的案例里,我们仍然需要按捺住冲动,老老实实去完成该做的事情:
在实验室里,测试两种药物对新冠病毒的抑制作用(吉利德公司宣称正在做这些实验;https://www.gilead.com/news-and-press/company-statements/gilead-sciences-statement-on-the-company-ongoing-response-to-the-2019-new-coronavirus);更重要的是,尽快组织设计严格和合理的人体临床试验,尽可能令人信服地证明两种药物真的能够实实在在的帮助患者。
实际上克立芝已经有相关的临床试验启动了(曹彬等,”一项评价洛匹那韦利托那韦联合标准治疗在2019新型冠状病毒感染住院患者中的疗效和安全性随机、开放、对照的研究“)。
而吉利德公司宣称已经赠送了一小批瑞德西韦给中国,我相信相关的临床研究也会很快开展(https://www.gilead.com/news-and-press/company-statements/gilead-sciences-statement-on-the-company-ongoing-response-to-the-2019-new-coronavirus)。
在那之前,我们还是要忍住立刻将“特效药”大规模推广的冲动,遵循科学和医学的自身规律,把该做的事情做好。
应该怎么用?
当然我估计你可能马上会有一个新的问题:既然如此,那为什么美国医生可以直接给新冠病毒肺炎的患者用上瑞德西韦?
这是一个特别值得单独拎出来聊聊的操作,学名叫做“同情用药”(compassionate use)。
这是美国FDA在2009年特别指定的一项政策,给极其紧急的药物临床应用开了一个小小的口子(https://www.fda.gov/news-events/public-health-focus/expanded-access)。按照这项规定,患者如果出现了紧急的而且危及生命的疾病,医生们可以考虑特别申请使用那些其实还没有获得批准上市,仍然在研发过程中的药物。在这一次,美国医生面对全美第一例新冠病毒肺炎的患者,就动用了“同情用药”这个绿色通道,给他争取来了一些还没上市的试验性药物。
但是我想你肯定能够想到,同情用药这个后门有一个巨大的风险:它如果开得太大,本质上会让整个药物开发和审批流程彻底失效,因为任何患者和医生都有可能在焦急的情况下尝试任何有可能有用的药物!因此FDA给同情用药的约束也是非常多的,患者的病情必须极度危急、手头毫无治疗方法、并且人体临床研究也不可能开展的时候,才会慎重考虑。
美国FDA每年仅仅会批准1000多个患者提出的同情用药的申请(https://web.archive.org/web/20180517061940/https://www.fda.gov/newsevents/publichealthfocus/expandedaccesscompassionateuse/ucm443572.htm#Expanded_Access_IND1)。考虑到美国人每年加起来求医问药的次数超过10亿次,同情用药的适用范围小到几乎可以忽略不计。
而针对美国这一例新冠病毒肺炎的患者,实施同情用药的原因是可以很容易的推测出来的:
患者病情较为危重,在住院期间仍持续恶化;而且面对一种全新的疾病,病情的后续发展难以预测;
缺乏任何有针对性的有效治疗手段;
美国仅有几例新冠病毒肺炎的患者,无法开展任何有统计意义的人体临床试验。
那我们中国的情况呢?很明显是不一样的:
在国内,新冠病毒肺炎的患者数量庞大,设计和完成一个人体临床试验并不是特别困难的事情;
患者绝大多数是轻症患者,在治疗过程中依靠传统的支持治疗和抗病毒治疗就足以顺利痊愈,也不需要动用未知风险很大的新治疗方法。
根据这些讨论,我想瑞德西韦在中国的应用路径其实就非常清楚了:
吉利德公司赠送的药物,一部分可以用来抢救病情危重的一部分新冠病毒肺炎患者。中国药监局也已经在2017年通过了中国版的同情用药方案,一切都有章可循。
http://www.ccpie.org/cn/yjxx/yphzp/webinfo/2017/12/1515083849140263.htm)
与此同时,这些药物还应该用来开展正规的人体临床试验,尽快确定它对于新冠病毒肺炎患者的安全性和疗效。如果还不错,那么我们当然就可以大大拓展这种药物的使用范围,让更多患者受益;如果不行,那么我们也可以在第一时间获知这些风险,及时叫停“同情用药”。
而如果确实证明安全好用,我们也可以和吉利德公司一起推动这种药物的正式上市和进口(同时包括大范围的降价),保证中国患者能够使用到。
还是那句话,欲速则不达。
再强调一次,不管疾病有多严重,不管我们期待新药和新疫苗的愿望是多么迫切,新药和新疫苗开发的规律无法被逾越。随意缩短研究的时间和标准,看起来好像是急人民之所急,但是可能会付出我们谁也无法接受的惨痛代价!
(update一个好消息:瑞德西韦随机、双盲、对照III期临床研究光速启动,总样本量270例,入组轻、中度新冠肺炎患者,由中日友好医院曹彬教授牵头,试验预期于后天(2月3日)开始,4月27日结束。)
【作者介绍:王立铭,浙江大学教授,科学作家,著有《上帝的手术刀》《生命是什么》等 ,知名科学科普博主。】


