2019 年 4 月 4 日,预印本网站 BioRxiv 刊登了一篇来自美国普渡大学团队的文章(未经过同行评议)。
这篇名为“NgAgo-enhanced homologous recombination in E. coli is mediated by DNA 1 endonuclease activity”的文章,主要阐述了 NgAgo 核酸内切酶活性介导增强大肠杆菌的同源重组,即NgAgo 具备内切 DNA 的能力(区别于从线性的DNA分子两端的外切)。
而 NgAgo,正是韩春雨论文造假事件中的核心蛋白因子。NgAgo 是否可以作为一种 DNA 引导的核酸内切酶在真核生物内靶向性切割 DNA,也是在韩春雨论文造假事件中的最关键问题之一。
图丨普渡大学论文(来源:BioRxiv)
NgAgo 走进公众视野是在 2016 年。当时,韩春雨领衔的 NgAgo 研究既在中国开启了一轮“造星运动”,也引发了后续强烈反弹的关注和论文造假风波。2016 年 5 月 2 日,河北科技大学韩春雨作为通讯作者在国际著名学术杂志 Nature Biotechnology 发表了题为“DNA-guided genome editing using the Natronobacterium gregoryi Argonaute”的研究论文。这一论文主要描述了 NgAgo 可进行 DNA 引导的基因组编辑并阐明了其中的原理,该发现当时被喻为 CRISPR-Cas9 基因编辑技术后又一“强大”基因编辑“利器”。
图 | 河北科技大学副教授韩春雨
2016 年 7 月 29 日,澳大利亚科学家 Gaetan Burgio 发表长文,表示不能重复韩春雨论文中的一些结果;国际转基因技术协会则给会员群发邮件,告诫大家“NgAgo 无法在哺乳动物细胞中进行基因编辑,不要再浪费时间、金钱、人力和课题”。这一新的发展随后被国内多家媒体报道,NgAgo 争议由学术界的国际化、专项社会关注的大众化、白热化。
到了 2016 年 8 月 2 日,Nature Biotechnology 首次对争议表态,“已有若干研究者联系本刊,表示无法重复这项研究。本刊将按照既定流程来调查此事。”8 月 8 日,Nature 杂志则争议做了专题新闻报道,称有不愿透露姓名的科学家向 Nature 记者证实实验的可重复性。河北科技大学则表示,在一个月之内韩春雨将采取适当形式公开验证,届时将有权威第三方作证。8 月 9 日,韩春雨应公益组织 Addgene 要求,发布新版的 protocol。直到 2017 年 8 月 3 日, Nature Biotechnology 发布声明,撤回韩春雨团队 2016 年 5 月 2 日发表在该期刊的论文。该风波随着撤稿公告的公示告一段落。
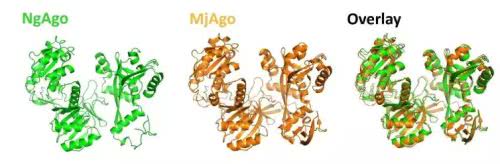
图丨 NgAgo 三维重建(NgAgo-enhanced homologous recombination in E. coli is mediated by DNA 1 endonuclease activity)
那么,普渡大学这次最新的研究,是否能够解答此前人们对 NgAgo 的疑问呢?
在了解 NgAgo 前,我们来认识一下 pAgo。pAgo,即原核生物 Argonautes,其与已成熟的 CRISPR-Cas 基因编辑系统相似,也是通过与导向单链核酸相结合,进而对其导向链识别的靶向链进行切割,完成对目标 DNA 的编辑工作。
但与 CRISPR-Cas 基因编辑不同的是,pAgo 并不需要一个额外的与靶基因相邻的前间隔序列邻近基序( protospacer adjacent motif, PAM )的短片段DNA
,这在理论上可以对任意序列进行 DNA 编辑工作而不再受到需要PAM存在的限制了。也是由于其具有强大的 DNA 编辑潜力,因此被研究人员誉为基因编辑的“万能钥匙”。不过,由于研究深入程度和技术等原因,pAgo 一直没有开发出像 CRISPR-Cas 这样既简洁又富有功能性的准商业化产品。
NgAgo 作为 pAgo 的候选者,近年来才被逐渐发现并提纯,但此前的研究并没有让各国科学家们意识到它具有 DNA 核酸内切酶的作用。这一分子来源于嗜盐古菌这一古老的原核生物,在其胞内表达较低,但在非嗜宿主体内重折叠后也不具备 DNA 编辑功能。
先前的研究也证实重折叠后的 NgAgo 并不能在体外完成 DNA 编辑工作,不过可以在 37℃环境中的菌体内具备基因组编辑的功能。而在普渡大学这次的研究却显示,NgAgo 确实具有 DNA 内切作用。
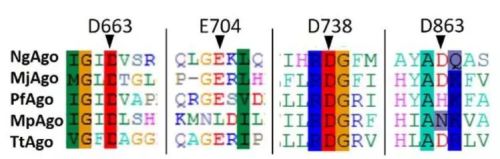
图丨 NgAgo 氨基酸序列分析(NgAgo-enhanced homologous recombination in E. coli is mediated by DNA 1 endonuclease activity)
普渡大学整个实验的思路是这样的,首先是对 NgAgo 提纯。在这个环节,团队将 NgAgo 基因与 GST 和 His 标签重建载体,转化菌体后 22 °C培养,使用 IPTG 诱导,发现表达的 NgAgo 呈现可溶和包涵体混合表达情况,分别利用 Ni 柱和谷胱甘肽琼脂糖柱层析纯化,得到可溶和重新折叠的纯化的 NgAgo 分子。同时根据氨基酸序列再用计算机进行了分子三维重建。结果显示,NgAgo 具有常规的 N-末端以及 PIWI、MID 和 PAZ 结构域,同时还具有潜在的单链 DNA 结合(repA)结构域。
随后,研究者对纯化后的 NgAgo 进行了体外活性及其功能检测。他们发现,可溶性且非在折叠结构的 NgAgo 分子在体外具有随机 DNA 切割功能。
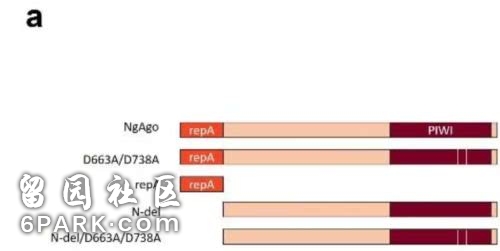
图丨 NgAgo 的 repA 和 PIWI 两个辅助结构域(NgAgo-enhanced homologous recombination in E. coli is mediated by DNA 1 endonuclease activity)
具体而言,究竟这一分子各个结构域都具有什么不同的功能?
研究者首先利用 repA 敲除体和 repA 突变体分析了 repA 这一结构域的功能,结果发现,repA 主要负责识别和剪切质粒 DNA。随后对 PIWI 这一结构域的功能测定显示,其结果类似于 repA,也具有 DNA 剪切作用。因此,负责实验的 Kevin V. Solomon 教授断定,NgAgo 是一个核酸内切酶,且依赖于 repA 和 PIWI 实现其 DNA 酶切功能。
因为哺乳动物体内具有组蛋白,对 pAgo 的活性均具有抑制作用,研究人员选择了在大肠杆菌体内测试 NgAgo 的作用,结果显示 NgAgo 可在大肠杆菌内进行 DNA 剪切功能,同时更为细致的研究表示,PIWI 结构域对于靶向剪切并不是那么重要,其可随机剪切一部分 DNA,但对于调控整个 NgAgo 的功能至关重要。另外,repA 这一结构域则主要负责靶向剪切。PIWI 和 repA 这两个结构域对于 NgAgo 在原核生物中实现其 DNA 内切功能均十分重要。
从普渡大学的结果来看,NgAgo 无论在体内体外均可实现其 DNA 内切的作用。在体外实验中,可溶且非再折叠的 NgAgo 可切割靶向的 DNA 链,在大肠杆菌内 NgAgo 在名为 repA 和 PIWI 两个功能性结构域的帮助下,NgAgo 可通过诱导其蛋白内靶向序列的双链断裂进而增强菌体内的基因同源重组。
这些研究从侧面证实了 NgAgo 确实具有 DNA 内切作用,是一个名副其实的 DNA 内切核酸酶,同时也表明,可溶性的 NgAgo 可以切割靶向区的 DNA。在这一过程中,PIWI 结构域的缺失会导致靶向基因的识别困难,进而降低 NgAgo 的 DNA 剪切力。
图丨刘东团队发现 NgAgo 诱导的 fabp11a 基因敲除可导致斑马鱼眼睛发育缺陷(来源:NgAgo-based fabp11a gene knockdown causes eye developmental defects in zebrafish)
在普渡大学的这个研究之前,还有两次来自国内的关于 NgAgo 的研究进展也值得注意。
2016 年 11 月,中国南通大学刘东团队的研究成果表明,NgAgo 可以在 gDNA 的引导下与靶基因相结合,同时可以抑制靶基因的转录过程,进而降低靶基因的表达水平,但该团队也否认了 NgAgo 具有 DNA 酶切作用,不具备 DNA 编辑功能。这篇文章发表于 2016 年 11 月 11 日的 Cell Research 杂志。
令人意外的是,在 2019 年 1 月 22 日,中国学者张安定教授的研究团队发布成果表示,pAgo 可以增强细菌同源序列的定向重组,并证实 NgAgo 系统通过其类似 PIWI 结构域与重组酶 A(recA)相互作用进而增强 recA 介导的 DNA 链的重组。他们的研究揭示了一种增强同源性序列引导的细菌基因编辑系统。研究发表于 Nucleic Acids Research 杂志。
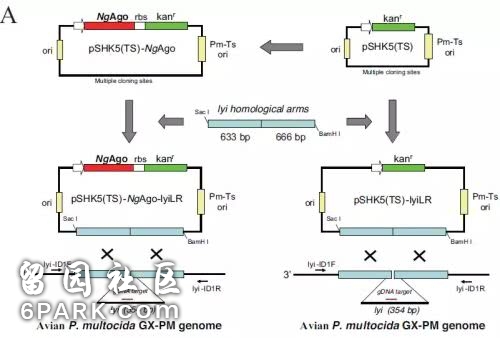
图丨多杀巴斯德氏菌和大肠杆菌中的 NgAgo 基因编辑系统(来源:The prokaryotic Argonaute proteins enhance homology sequence-directed recombination in bacteria)
以上的这些研究都表明,NgAgo 具有可编程的 DNA 切割能力。但需要注意的是,作为基因编辑应用的强大工具,NgAgo 的开发仍存在若干挑战:高脱靶活性,随机性剪切率高,表达低,在真核宿主中潜在的低活性。尽管如此,进一步的研究可能会利用蛋白质工来克服这些障碍,并开发 NgAgo 作为基因编辑的强大工具。
对于科学家在 NgAgo 上取得的最新进展,中科院遗传与发育研究所高级工程师姜韬对 DeepTech 表示,这个工作还是非常初步的,很多实验结果不够理想。
“比如,用大肠杆菌表达 NgAgo 蛋白是存在包涵体的,而且包涵体复性不成功,可溶性部分不能排除折叠不正确的 NgAgo。同时,没有看到 NgAgo 的纯度数据和证据,而大肠杆菌自身的 DNA 内切酶很多,活性也高,必须彻底排除。这类实验要求阴性、阳性对照药充分,我也没有看到完备的实验证据。整个工作最有价值部分是实现了在大肠杆菌细胞内实现了增加目的基因的重组率,这是一个旁证,遗憾的是这个基因组编辑究竟是否真实,没有后续的 DNA 测序结果给与直接的证明。 作者聚焦研究的 NgAgo 能否在真核细胞内实现 DNA 内切,是能够作为成熟的基因组编辑工具的最基本条件,目前还是没有进展。我个人以为,目前的结果难以通过严格的同行评议,必须完善和补充我上面提出几点重要实验”,他说。
(来源:普渡大学)
他透露,很多科学家都清楚 NgAgo 的潜在优点-不受额外的邻近序列(PAM)限制,意味着可以编辑任意部分。相信我国的韩春雨也注意到了,但他没有真正重复出做出其声称的基因组编辑,其他科学家也没有按照他提供的方法做出 NgAgo 的基因组编辑。普渡大学的成果是个初步结果,甚至很粗糙,仍然需要完善和补充实验,如果真实可行,还需要以建立起稳定可靠的实验条件,并给出基因组编辑成功率和脱靶比例的数据。
还有一点要指出的是:不论别人在 NgAgo 上做出了什么新进展,韩春雨都需要自己重复出他发布的那个实验。
总而言之,在之前的闹剧之后,依然有学者正在致力于发展 NgAgo 技术,普渡大学的最新成果再次将 NgAgo 推到全球基因编辑研究者的眼前,表明其确实具有作为 DNA 编辑工具的潜力。虽然这一“利器”在真核生物并未发现其内在的 DNA 编辑能力,但这一研究结果也足以让研究者们振奋。相信随着对 NgAgo 的不断认识和开发,我们有希望找到另一款强大的 DNA 编辑利器。
参考:
Paula Pandolfi, Frederick S. Gimble, Kevin V. Solomon. NgAgo-enhanced homologous recombination in E. coli is mediated by DNA 1 endonuclease activity


