谁能想到,ChatGPT的预测成真了!
就在刚刚,2023年诺贝尔生理学或医学奖出炉了。
获奖者是Katalin Karikó和Drew Weissman,理由是发现了核苷碱基修饰,从而开发出有效抗新冠病毒的mRNA疫苗。
北京时间 2023 年 10 月 2 日 17 时 45 分左右,2023 年诺贝尔生理学或医学奖公布结果。今年,Katalin Karikó 和 Drew Weissman 因核苷碱基修饰方面的发现而获奖,这些发现使得开发针对 COVID-19 的有效 mRNA 疫苗成为可能。

图源:nobelprize.org
诺奖官网对 Katalin Karikó 和 Drew Weissman 的研究成果进行介绍如下。
两位诺贝尔奖获得者的发现对于在 2020 年初开始的大流行期间开发出有效的 mRNA 疫苗来预防 COVID-19 至关重要。他们的突破性发现从根本上改变了我们对 mRNA 如何与免疫系统相互作用的理解。
因此,在现代人类健康面临最大威胁之一的情况下,这两位诺贝尔奖获得者为以前所未有的速度开发疫苗做出了贡献。
大流行前的疫苗
接种疫苗可刺激机体形成对特定病原体的免疫反应,使得人体之后暴露于病原体时能先发制人。以灭活或减活病毒为基础的疫苗早已问世,如小儿麻痹症疫苗、麻疹疫苗和黄热病疫苗。1951 年,Max Theiler 因研制出黄热病疫苗而获得诺贝尔生理学或医学奖。
近几十年来分子生物学的进步,基于单个病毒成分而非整个病毒的疫苗已经开发出来。病毒遗传密码的部分内容,通常是对病毒表面蛋白质的编码,被用来制造蛋白质,以刺激阻断病毒的抗体的形成。乙型肝炎病毒和人类乳头瘤病毒的疫苗就是例子。
另一种方法是将病毒的部分遗传密码转移到无害的载体病毒上。埃博拉病毒疫苗就采用了这种方法。当注射载体疫苗时,被选中的病毒蛋白质会在细胞中产生,从而激发针对目标病毒的免疫反应。
生产全病毒、蛋白和载体疫苗需要大规模细胞培养。这种资源密集型工艺限制了为应对疾病爆发和大流行而快速生产疫苗的可能性。因此,研究人员长期以来一直试图开发独立于细胞培养的疫苗技术,但事实证明这具有挑战性。

图1. COVID-19 大流行前的疫苗生产方法
mRNA 疫苗:一个有前景的想法
在我们的细胞中,DNA 中编码的遗传信息被转录成信使 RNA (mRNA),mRNA 是蛋白质产生的模板。20 世纪 80 年代提出了一种了无需细胞培养即可产生 mRNA 的有效方法,即体外转录。这决定性的一步加速了分子生物学在多个领域应用的发展。将 mRNA 技术用于疫苗和治疗目的的想法也开始兴起,但前路上仍有障碍。
体外转录的 mRNA 不稳定且难以传递,需要开发复杂的载体脂质系统来封装 mRNA。此外,体外产生的 mRNA 会引起炎症反应。因此,开发用于临床的 mRNA 技术的热情最初非常有限。
这些障碍并没有让匈牙利生物化学家 Katalin Karikó 灰心,她致力于开发利用 mRNA 疗法。20 世纪 90 年代初,她在宾夕法尼亚大学担任助理教授,尽管在很难说服研究资助者她的项目具有重大意义,但她始终坚持自己的理想,即实现 mRNA 疗法。
Karikó 在大学里的一位新同事是免疫学家 Drew Weissman。他对树突状细胞感兴趣,而树突状细胞在免疫监视和激活疫苗诱导的免疫反应中具有重要功能。在新想法的推动下,两人很快开始了合作,重点研究不同 RNA 类型如何与免疫系统相互作用。
突破
Karikó 和 Weissman 注意到,树突细胞会把于体外环境转录的 mRNA 识别为外源物质,进而导致树突细胞的激活和炎症信号因子的释放。他们惊讶于为何体外环境转录的 mRNA 会被树突细胞识别,而哺乳动物细胞转录的 mRNA 则并不会引发同样的反应。Karikó 和 Weissman 意识到,树突细胞一定是靠某些重要特征区分了不同类型的 mRNA。
RNA 由四种缩写为 A、U、C、G 的碱基所构成,相应地,遗传密码的载体 DNA 由四种缩写为 A、T、C、G 的碱基所构成。Karikó 和 Weissman 知道,哺乳动物细胞中的 RNA 核苷酸碱基常存在化学修饰,而体外环境转录的 mRNA 并非如此。他们还惊诧于体外环境转录的 mRNA 中碱基修饰的缺失可以解释非预期炎症反应的发生。
为了研究这一点,他们合成了多种不同的 mRNA,每种都在碱基上有独特的修饰,并将这些 mRNA 输送至树突细胞中。研究结果令人震惊:当 mRNA 中引入碱基修饰时,炎症反应几乎消失。这改变了我们对细胞识别和响应不同种类的 mRNA 的典型认知。
Karikó 和 Weissman 很快意识到他们的发现将会对 mRNA 疗法产生重大影响,他们这一具重大意义的研究成果于 2005 年,也就是新冠病毒流行的 15 年前发表。
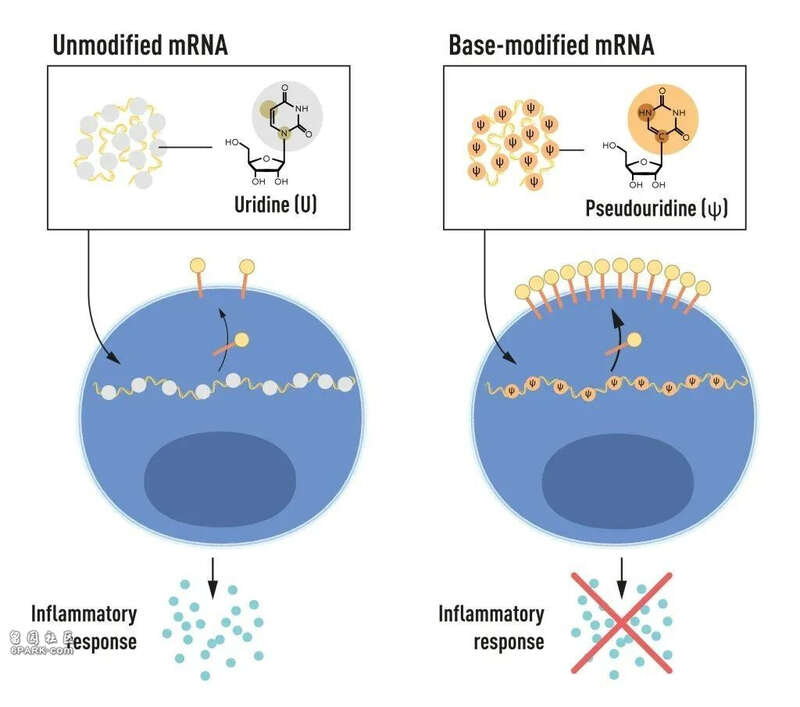
图2. mRNA 包含四种不同碱基,缩写分别为 A、U、G、C。诺贝尔奖获得者发现了核苷碱基修饰后的 mRNA 可以用来阻断炎症反应的激活(信号分子的分泌),并增加 mRNA 传送至细胞时的蛋白质合成。
在 2008 年和 2010 年发布的后续研究中,Karikó 和 Weissman 阐明了相比未修饰的 mRNA,碱基修饰后的 mRNA 可以显著增加蛋白合成。这一效应可归结于调节蛋白质合成的酶的激活减少。通过这些发现,即碱基修饰可以同时降低炎症反应和增加蛋白质合成,Karikó 和 Weissman 根除了 mRNA 临床应用中的关键障碍。
mRNA 疫苗发挥了其潜力
人们对 mRNA 技术的兴趣开始升温,2010 年,多家公司开始致力于开发该疗法,开始研发针对寨卡病毒和中东呼吸综合征冠状病毒的疫苗;后者与 SARS-CoV-2 密切相关。
COVID-19 大流行爆发后,以破纪录的速度开发出了两种编码 SARS-CoV-2 表面蛋白的碱基修饰 mRNA 疫苗。据报道,保护效果约为 95%,这两种疫苗早在 2020 年 12 月就获得了批准。
mRNA 疫苗开发的灵活性和速度令人印象深刻,这为将新平台用于其他传染病的疫苗开发铺平了道路。未来,该技术还可用于递送治疗蛋白和治疗某些类型的癌症。
基于不同方法的其他几种 SARS-CoV-2 疫苗也被迅速引入,全球共接种了 130 多亿剂 COVID-19 疫苗。这些疫苗挽救了数百万人的生命,预防了更严重的疾病,使社会得以开放并恢复正常状态。今年的诺贝尔奖获得者通过他们对 mRNA 碱基修饰重要性的基本发现,在我们这个时代最大的健康危机中为这一变革性发展做出了重要贡献。
3次被解雇,40年冷板凳,她凭借mRNA疫苗终获诺贝尔医学奖

文/陈列平 凤凰网《CC情报局》 特约撰稿员 免疫学博士
核心提要:
1. 北京时间10月2日下午,2023年诺贝尔生理学或医学奖率先揭晓,美国女科学家卡塔林·卡里科(Katalin Karikó)和德鲁·魏斯曼(Drew Weissman)获奖,其中卡塔林·卡里科发现了基于mRNA修饰的新治疗技术,这位默默无闻了40年,三次被解雇,曾在美国数个大学试验室被赶来赶去、偏执于mRNA免疫反应研究的女科学家终于得到她最大的回报。
2. 长期以来,卡里科对mRNA 的 40 年不间断的研究,一直被科学界认为是“走在一个无聊的死胡同里”。卡里科在匈牙利布达佩斯附近的一个乡村里长大,她对自然科学非常着迷,14 岁时在全国生物竞赛中获得第三名。1978年,卡里科在塞格德大学拿到了博士学位,开始痴迷于研究,RNA,并把这做为自己一生的研究目标。研究mRNA的过程中,她三次被解雇,长期受到侮辱。
3. 卡里科在人生的低谷苦苦爬行了十多年后,终于撑到了1989年,拿到了人生中的第一笔经费10万美元,熬到了她人生中的第一个贵人德鲁·魏斯曼出现。魏斯曼发现了卡里科的价值,联合发表论文,却再次遭到冷遇。但他们的发现与研究被史丹佛大学教授德瑞克·罗西(Derrick Rossi)看见,并认识到该研究用来研发药物、疫苗的可能。2020年新冠疫情的爆发,这一技术成为了开发新冠疫苗的最先进平台,它几乎挽救了美国与欧州的大部分国家。
“我们所有接种 Pfizer-BioNTech 或 Moderna 疫苗的人都欠匈牙利裔科学家 Katalin Karikó 的一份巨额谢意,她40多年来一直在挑战怀疑论者,顽固地将 mRNA 作为抗击疾病的工具,发现了基于mRNA修饰的新治疗技术,使其减少免疫反应,为mRNA 新冠疫苗的诞生铺平了道路。”去年9月底,由2021年的诺贝尔奖化学奖获得者,美国生物化学家詹妮弗·杜德娜所撰写的关于卡塔琳·卡里科(Katalin Karikó) 入选《时代》杂志 100 位最具影响力人物名单的理由时,写下了这段话,以表达她对这位科学家的尊敬。
现在,这位默默无闻了40年,因为没有科研经费,没有科研成果,三次被解雇,曾在美国数个大学试验室被赶来赶去、偏执于mRNA免疫反应研究的女科学家,终于得到她最大的回报。
她所有默默无闻的奋斗变成了人们对抗新冠疫情的最有力武器。

10月2日,2023 年诺贝尔生理学或医学奖联合授予 Katalin Karikó 和 Drew Weissman,“表彰他们在核苷碱基修饰方面的发现,这些发现使得开发针对 COVID-19 的有效 mRNA 疫苗成为可能”

她将与Drew Weissman分享 1,100 万瑞典克朗的奖金(约合 7,201,250 人民币)。

对卡里科被抛弃与躲在黑暗中默默无闻的努力的的肯定,始于2000年。去年4月,作为被认为可以结束新冠大流行的关键工具,《纽约时报》介绍了mRNA疫苗以及这项革命性技术背后的卡里科的贡献。
65岁的卡里科才终于走到前台。
卡里科作为mRNA关健技术的发明者。从mRNA疫苗成功上市开始,人们就认为她应当得到更大的肯定,获得对于一个科学家来说,最高的荣誉:诺贝尔医学奖。
2021年10月4日,这位貌不惊人的的科学家与她的合作者魏斯曼教授,拿到了医学界几乎所有重要的奖项:9月21日,2022 年生命科学突破奖以及 300 万美元奖金(科学界最赚钱的奖项),而在9月27日,她又拿到了号称诺贝尔奖风向球的拉斯克奖。据统计,至少有十位拉斯克奖得主,最后都拿到了诺贝尔奖。但她并没有如愿拿到诺奖。但人们认为这一切已足够了。
卡里科现在是BioNTech高级副总裁。她的合作者是宾夕法尼亚大学佩雷尔曼医学院疫苗研究教授 Drew Weissman 博士。他曾是卡里科的贵人,他发现了RNA研究的意义,给了她一份工作,并与他一起赋予了mRNA新的意义。卡里科与魏斯曼 一起拥有非免疫原性核苷修饰 RNA 应用的美国专利。
现在,他们的发现与坚持都有了重大意义。RNA技术现在成就了新冠疫苗,并在癌症疫苗中,开始发挥功效。
所有最冷门的研究,以及最冷门的科学发现,最终都会在某一种历史的转折关头,挺身而出。这个才是科学研究最大的意义。
而这也是对于一个科学家孤坐40年冷板凳的最大奖赏。

▎卡里科和魏斯曼是一个非常成功的合作典范。他们选择了疫苗而不是药物,做为mRNA最佳应用方向,并在疫情期间给了这种技术应有的前景。也使这一技术得到了应有的尊敬与未来。

三次失去工作,被降职,几乎没有任何研究经费,坐了40年的冷板凳,65岁才大获成功
长期以来,卡里科对mRNA 的 40 年不间断的痴迷研究,一直被不理解的科学界的同事,认为她一直走在一个“无聊的死胡同”里。在这个绝望的看不到未来的孤军奋战的死胡同里,她长期受到忽视、蔑视、解雇、降职,无数次申请经费被拒,并受到驱逐出境的威胁——以及其他侮辱。
这使她的成功显得更具传奇与寓言色彩。甚至有点励志。
卡里科在布达佩斯附近的一个乡村里长大。父亲是屠夫。没有任何科学基因的她对自然科学非常着迷,14 岁时在全国生物竞赛中获得第三名。
1972年,卡里科进入匈牙利最著名的大学之一塞格德大学就读。她在迪斯科舞厅遇到了她的丈夫贝拉·弗兰西亚。1978年,卡里科在塞格德大学拿到了博士学位,随后进入塞格德生物研究中心工作,开始痴迷于研究mRNA,并把这做为自己一生的研究目标。
这种发现于1961年的加州理工大学实验室里的mRNA,是一种特别的基因中介,它能透过传送讯息到人体内,来教育或引导人体细胞来抵抗病毒。理论上,如果能操控制造mRNA,告诉它要制造哪些蛋白质,就会相应去抵抗疾病。也因此,mRNA被学界认为是相对先进的机制,许多科学家都曾前赴后继,找到打开这个梦想的开关,却因为人体免疫系统会杀死它,大多失败。人们可以合成mRNA,但无法阻止它产生免疫反应。
当大多数科学家都停止研究后,卡里科仍然选择向前。但这种选择显然让她付出了巨大的代价。
1985 年,卡里科工作的实验室失去了资金。没有科研成果的卡里科,在她30岁那年,被解雇了。

她在美国寻找机会,遥远的费城天普大学给了她一个工作。
这家人卖掉了他们惟一值钱的资产,一辆汽车,在黑市上换了900英磅。她的祖国要求人们在离开这个国家时,只能拿走一百美元。她把钱偷偷藏在一只红眼圈的棕色大泰迪熊里。直到今天,她还把它放在女儿童年的房间里。

这家人拿着单程票,于1985年进入了美国。
她在美国的第一个职位是费城天普大学的博士后,每年为她赚取 17,000 美元以养家糊口。“我知道如何保持有限的预算,并且每周在家庭食物上花费不超过 30 美元。那是我们的极限,”她说。
但这份微薄的薪水,她也只拿了三年左右。
虽然 mRNA 疗法有明确的前景与未来,但面对多次失败,人们对寻找一种可以变成现实的方法的热情崩溃了。这个技术致命的缺陷是,它在到达靶细胞之前,就被人体的防御系统破坏了。更严重的是,人体会本能地反击外来入侵者,产生严重的免疫反应,甚至导致死亡。科学界已断言mRNA技术仍然“一潭死水”。并且学校与政府机构也拒绝拨款。
对于大学的试验机构来说,没有经费,原则上就没有存在的意义。
卡里科在天普大学的团队解散了。她第二次失去了工作。
1989 年,她在宾夕法尼亚大学的心脏病专家Elliot Barnathan(巴纳森)博士那里找到了一份工作。这是一个低级职位,研究助理教授。她和巴纳森尝试用 mRNA 技术来改善心脏搭桥手术后的血管。甚至尝试将mRNA注射到细胞中,看是否能产生蛋白质,然后利用同位素技术看这些蛋白质在细胞中哪个位置以及如何发挥作用。但这些并不成功。
后来巴纳森很快离开了学术界,接受了一家生物技术公司的职位,卡里科失去了依靠,彻底地失去了研究经费来源。
而只有找到一个新的实验室接受她,她才能继续留在宾夕法尼亚大学。她后来被神经外科收留,试图探讨使用 mRNA 来治疗脑部手术后出现血栓的患者。但相同的结局很快出现。收留她的系主任辞职,她第三次失去了试验室与依靠。
这使她在宾大的记忆并不愉快。在这里她度过了最艰难的一段学术时光。她从一个实验室被赶到另一个实验室,依靠一个又一个资深科学家来收留她。她的年收入从未超过 60,000 美元。
“宾夕法尼亚大学的前董事长对我很糟糕,曾一度将我赶出实验室,”卡里科曾在接受《华盛顿邮报》的采访时,抱怨说。“那是我取得一些主要发现的地方,但他不明白。他告诉我,可以在靠近存放实验动物的房子附近,设立一个小办公室。”
但卡里科对这样的条件并不在意。她认为办公室大小并不影响对于研究的进展。
她在最初的六年里,好像走在一个黑暗的遂道里,试图找到那一点点光。但学校与政府拔款机构,选择拒绝将油灯点亮。她送上去的所有拨款报告,几乎都被驳回了。而她的研究,也仍然一事无成。
到 1995 年,在宾夕法尼亚大学任教六年后,卡里科迎来了她人生中的至暗时刻。她被诊断出患有癌症(尽管后来证明是误诊),就在同一周,她收到了学校的最后通牒:要么放弃 mRNA 研究,要么失去她享有盛誉的教职。她选择了降职——并大幅减薪——这样她就可以继续研究似乎并没有未来的mRNA技术。卡里科说,在被降职后,她要求宾夕法尼亚大学的新董事长恢复她原来的职位,结果却被告知她不是“教职员工”。
她在职业生涯中经历了一些异常艰难的时期。职业前景与研究前景,几乎瞬间降为了最低点,朋友们,包括学校,要求她换一个研究方向,或者重新制订职业规划。但她似乎认定了自己大学时就确立的方向,她顽固的坚持下来了。并不容人打扰。


她遇到了人生中的两位“贵人”,并和他们一起,发现了这一改变世界的技术
卡里科在人生的低谷苦苦爬行了十多年后,终于撑到了1989年,卡里科终于拿到了人生中的第一笔经费10万美元,熬到了她人生中的第一个贵人出现。
这位贵人是和她同一所大学内研究免疫学的教授魏斯曼(Drew Weissman)。多年后,她还可以回忆起他们在复印机旁边的相遇与聊天的经历。魏斯曼那时刚从美国国家卫生研究院跳槽到宾大。
这两位科学家都正在遭遇不同的研究困境。
魏斯曼正在研制一种针对艾滋病毒的疫苗。他采用了DNA疫苗策略,却以失败告终。卡里科在mRNA研究中遭遇到“注射mRNA后可激发机体严重的天然免疫反应,而这造成了受试动物的死亡。”除此之外,她正面临随时被宾大扫地出门的窘境。因为她仍在经历降薪降职以及第N次被回绝拔给她任何研究经费。
卡里科告诉他:“我能造出任何一种mRNA。也许你可以在HIV疫苗中尝试一下这种技术。”
魏斯曼发现了卡里科的价值,将她邀请到自己的试验室担任初级研究员。合作研发mRNA疫苗。

▎卡里科和魏斯曼的合作是科学界的一段佳话。媒体甚至认为魏斯曼是卡里科的贵人。如果从将卡里科从困难中救出这一点来说的话,他符合这一说法。
6年后,他们发现了如何在不引起严重免疫反应的情况下让 mRNA 进入细胞的方法。用弱化的版本替换了一个RNA的模块。这意味着 mRNA 可用于改变细胞的功能,而不会引发免疫系统攻击。但这一研究结果并没有得到科学界应有的回应。
当时大多数科学家对这项将成为 mRNA 疫苗的基石的技术不感兴趣,因为他们认为有更好的免疫方法。比如已存在了几十年的传统的灭活疫苗,因为这一技术相比mRNA的未知风险来说,表现更稳定,也更可控。
他们的论文在被十多家期刊多次拒绝后,于2005年发表在Immunity《免疫》杂志上。仿佛在深海中沉入了一小块石头。几乎没有受到科学界更多的关注。而且学界认为,这一发现似乎过于深奥。她的这一认知不被当时的科学界认为是一种远见,而是一个不切实际的幻想。
2006年,卡里科和魏斯曼创立了一家公司RNARx,卡里科担任这家公司的CEO,此后RNARx获得了来自政府的90万美元的资助。然而,2010年,宾夕法尼亚大学将卡里科和魏斯曼的专利卖掉了。RNARx公司尚未进入临床的项目就此夭折了。
卡里科再次变得一无所有。
但他们的发现与研究被另一个有远见的人看见,并使它开始爆发应有的光亮。他被称为卡里科的第二个贵人。史丹佛大学教授德瑞克·罗西(Derrick Rossi)从这一系列的论文中看到了一个巨大机会:这个技术可以用来研发药物、疫苗,以及其他所有的可能”。
他决定运用她的发现,2010年,他找到了一笔投资,与两位医药界有影响力的科学家一起创立了Moderna公司。此后,Moderna公司曾找到卡里科寻求合作,可惜这个专利已经被卖掉了。

▎图/在布达佩斯的一幅壁画描绘了出生于匈牙利的科学家卡里科的形象。她现在是这个国家的英雄。
在德国,另一个团队也看到了这项技术的巨大潜力,并组建了一家新公司BioNTech。该公司将开发基于信使RNA的癌症疫苗。2013年,宾夕法尼亚大学不再续聘卡里科,这家连公司网站也没有的公司聘请卡里科担任副总裁,帮助监督mRNA工作。
事实上,这两家公司的核心技术专利都是基于卡里科和她的合作者魏斯曼。当年买走这个专利的公司,将卡里科和魏斯曼的核心专利转让给了Moderna和BioNTech。这两家公司的MRNA技术虽然很前卫,但却并没有在癌症疫苗上获得突破。直到2020年新冠疫情的爆发,这一技术成为了开发新冠疫苗的最先进平台。
BioNTech 在数小时内设计了其 mRNA 疫苗,也即后来的辉瑞与复必泰疫苗。Moderna 在两天内设计出了莫德纳疫苗。
2020 年 11 月 8 日,辉瑞-BioNTech 研究的第一个结果出来了,表明 mRNA 疫苗对新冠病毒提供了强大的免疫力。卡里科对丈夫说。“哦,它有效,我早就知道它有效。” 为了庆祝,她吃了一整盒 Goobers 巧克力花生。
卡里科和魏斯曼于 2020 年 12 月 18 日在宾夕法尼亚大学接种了MRNA疫苗。他们的接种变成了一场新闻发布会,随着摄像机的闪烁,她开始一反常态地感到不知所措。宾大副校长告诉卷起袖子准备注射的医生和护士,这两位科学家的杰出研究,使新冠疫苗变成了现实。人群响起了热烈的掌声。
现在,辉瑞与莫德纳疫苗,是全球使用较多的疫苗之一,它几乎挽救了美国与欧州的大部分国家。尽管美国仍是全球疫情最严重的国家之一。

▎图/卡里科的另一个巨大成就就是培养出一位杰出的女儿Susan Francia。她曾在伦敦奥运会与北京奥运会上,两次拿过赛艇金牌。Francia 在宾夕法尼亚大学大二时开始划船,现在是一名大学教练,她的运动天赋来自她的父母。卡里科和先生都是马拉松选手。

mRNA 疫苗让卡里科和魏斯曼成为诺奖的热门人选。
Moderna联合创始人Chien也表示,“包括 Moderna 在内的所有mRNA 公司都归功于卡里科和魏斯曼的原创工作。如果没有他们的发现,RNA疫苗将不会像现在这样先进。”
《纽约时报》在她获得2021年拉斯克奖的文章称,“像她这样默默无闻地在实验室里工作了几十年,但一事无成的科学家应当还有很多吧,某种程度上来说,她算是一个历经失败但依然看到成功的幸运者。”
新晋诺奖得主:她用40年逆袭拯救全人类,还培养了一个奥运冠军
2020年12月起,英国、加拿大、美国等国家相继批准了辉瑞制药与德国BioNTech联合开发的新冠mRNA疫苗紧急使用,人们终于看到了结束全球新冠疫情的希望。与其他疫苗相比,mRNA疫苗具有诸多优点:首先是安全性高,mRNA不具备感染性,也不必整合到基因组,其在体内寿命可根据需要通过体外操作来实现(避免长期滞留带来危害);第二是免疫性好,目前的mRNA疫苗已较为稳定,可在细胞内进行高效表达产生蛋白质,启动高效免疫应答反应;第三,量产迅速,mRNA体外制备技术非常成熟,可根据需要快速、便捷地制备出大量疫苗。随着全世界的目光聚集在新冠mRNA疫苗上,这项技术背后曾经默默无闻的关键科学家也浮出水面,接受各大媒体的采访。她就是来自匈牙利的女生物化学家卡里科(Katalin Karikó),今年65岁了。

卡里科在宾州家中工作。from STAT
一 没有回头路
1955 年 1 月 17 日,卡里科出生于匈牙利东部小镇小新萨拉什(Kisújszállás)一间烧着木屑炉子的小屋。仔细检查父亲每日屠宰的猪,便是她的科学启蒙课。
1973年,卡里科考入匈牙利名校塞格德大学(University of Szeged),义无反顾地选择了理科。在大学里,她第一次在一场学术报告里听说了信使RNA(mRNA),它携带着DNA中的遗传信息,直接指导蛋白质的合成,承担着“传讯者”的角色。卡里科对这种神奇的分子产生了浓厚的兴趣。1978年,她选择攻读博士学位,重点研究mRNA的应用。
20世纪七十年代,基因工程诞生,不久基因治疗的概念也应运而生,但这些操作均是以DNA为目标,而卡里科却认为mRNA更有前途。毕业后,她选择了进入匈牙利科学院塞格德生物中心(Biological Research Centre, Szeged)生物物理研究所。当时,许多人博士毕业后去美国留学深造,但卡里科对此并不动心,她认为国内同样可以实现自己的愿望。遗憾的是,卡里科这个美好愿望于1985年破灭了,她被单位解雇了。
多年后,卡里科在一次接受采访时曾表示,如果她继续留在匈牙利国内,很有可能成为一个充满抱怨的、平庸的科研人员。无路可退的卡里科不得不重新开始找工作。一开始她想在欧洲找个职位,但最终,她只能远赴大西洋彼岸的费城。在那里,美国天普大学(Temple University)为她提供了一个博士后职位。
没有手机、没有信用卡,夫妇两人带着年仅两岁的女儿,踏上了异国他乡。政府不允许兑换超过100美元的现金,他们就在黑市卖掉了车,把900英镑缝在女儿的泰迪熊里偷偷带出境。卡里科说:“我们没有回头路。我们在那里举目无亲。”
1985年,卡里科在美国天普大学(Temple University)重启科研道路。遗憾的是,首站并不顺利。四年后,她与导师发生了一次冲突,主要原因还是两人对待mRNA观念有差异。像当时的许多科研工作者一样,导师也不看好mRNA的研究。1990年,卡里科加入宾夕法尼亚大学。这时,一项最新进展进一步坚定了她开展mRNA应用的决心。
二 也许我不够优秀,不够聪明
1990年,威斯康星大学一个研究小组首次将mRNA注射到小鼠体内(doi: 10.1126/science.1690918),并检测到了相应的蛋白表达;两年后,另一个研究小组进一步在大鼠中证明,体外注入的mRNA表达出的蛋白还具有生理活性。如果这两个结果成立,就意味着采用病原体关键蛋白的mRNA,也会产生病毒蛋白,并激发免疫应答,从而发挥疫苗的作用。
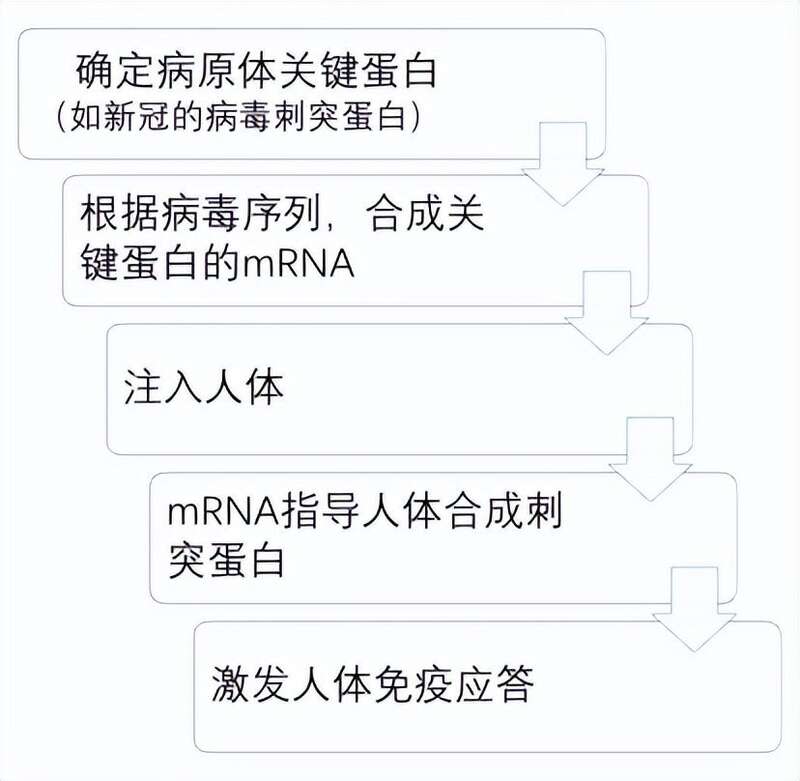
这个逻辑推理很容易获得,但是许多科学家对此并不看好。因为这么做存在诸多现实问题,用mRNA做疫苗至少有三大缺陷:稳定性差(目前这个问题依然存在)、体内效率低下和激发机体先天免疫系统(引起严重炎症反应,导致动物立即死亡)。在许多科学家看来,这些困难都是难以逾越的科学鸿沟,尤其是第三个缺陷,可能最终都难以搞定。这种费力不讨好的事情自然没几个人愿意做,再说传统的疫苗制备策略已足足够用,何必舍近求远?
“主流看法”势必会影响一个领域的发展。许多mRNA研究的大牛都退避三舍,不再提起用mRNA做疫苗这码事,领域内默默无闻的新兵遇到的阻力也就可想而知。
进入宾夕法尼亚大学的当年,卡里科就提交了基金申请,想尝试采用mRNA开发疫苗。在这样的主流背景下,申请失败了。然而没想到,随后几年,年年申请,年年被拒,竟达八年无法为这一课题申请到基金。她回忆说,“我每天晚上都在写基金、写基金、写基金,结果每次都被打回来、打回来、打回来。”你有千条妙计,我有一定之规;任你说得天花乱坠,我就不给你基金。这一今天看来并不怎么“大逆不道”的想法,同行专家就是不予通过。2004年诺贝尔化学奖得主赫什科(Avram Hershko)就认为,专家总是墨守成规,许多观点不值得接受(由于泛素加热后仍保持活性,由此他们认定泛素不可能是蛋白质)。
老板们终于看不下去了。1995年,来到宾大的第六年,卡里科迎来了降级降薪。她回忆到,她当时刚刚做出一些重要的发现,学校把她轰出了实验室,在动物房边上给她安排了一个小房间办公做实验。更惨的是,这个节骨眼,她又被诊断出癌症,需要进行两次手术,而她的丈夫由于签证问题不得不滞留在匈牙利,长达半年无法返美。她只能一边接受治疗,一边照顾孩子。
一般人有此遭遇,早就离开学术界了,但卡里科还是熬了下来:“我想过去别的地方,研究别的东西。我还想过可能是我不够优秀,不够聪明。我努力说服自己:万事已经俱备,我只需要把实验做得更漂亮就行了。”
幸运的是,卡里科最终康复了,并继续开展自己的实验。由于各方限制,做事可谓举步维艰。没经费订杂志,为了看到最新的论文,她还得去复印。在1997年一次复印时,卡里科结识了刚到宾大不久的免疫学家韦斯曼(Drew Weissman)。韦斯曼对卡里科的想法很感兴趣,决定资助她继续开展研究,她的项目也正式成为“韦斯曼-卡里科项目”。卡里科当时的境遇可说降到了冰点,待遇比技术员都要低,韦斯曼的帮助可谓是雪中送炭,不仅仅是资金支持,同样重要的还有精神鼓励。
三 峰回路转,再起波澜
卡里科的研究逐渐有所起色。1998年,期盼已久的基金终于得到批复,尽管只有区区10万美元,但至少是一个好的开始。第二年,又获得100万美元资助。卡里科和韦斯曼商讨后达成一致——需要首先解决mRNA应用的安全性问题,也就是理解mRNA诱发机体炎症反应的原因。
上世纪九十年代,先天免疫机制的阐明拓展了人们对免疫系统的认识。1998年,美国免疫学家巴特勒(Bruce Beutler)发现树突细胞等免疫细胞的表面存在Toll样受体 (TLR) 家族,能识别细菌成分(如脂多糖),两者结合就会激活并启动先天免疫应答,巴特勒也因为这一发现分享2011年诺贝尔生理学或医学奖。
卡里科推测,mRNA注射到动物体内诱发炎症,可能是因为它们可被TLR分子识别。为验证自己假说的正确性,卡里科首先建立一个体外系统模拟炎症反应,应用人工合成的mRNA直接处理细胞,确实激活了免疫应答,释放出大量免疫因子。进一步研究发现,多种TLR分子(包括TLR7,8等)确实可以识别体外注入的mRNA。
2004年,卡里科完成了一个关键实验。她从哺乳动物和细菌中直接提取mRNA,并用它们处理细胞,结果发现哺乳动物mRNA基本不激活免疫应答 (线粒体mRNA除外),而细菌mRNA则诱导细胞因子的释放,这一结果说明,诱发免疫应答的原因不在mRNA本身,而应该在其结构差异。当时已知,哺乳动物mRNA存在广泛的碱基修饰现象,而细菌等原核生物则通常不存在这一现象(与体外合成的mRNA类似)。于是,卡里科对体外合成的mRNA也进行了碱基修饰,结果使免疫应答能力大大减弱(后来动物实验也证明修饰后的mRNA不再产生严重炎症反应)。其实,哺乳动物识别非修饰mRNA(外源物成分),但对修饰mRNA视而不见的能力恰恰是免疫系统的基本特征——区分“非我”,也是机体对自身的保护。这一发现意味着,mRNA体内应用的安全性得到了有效解决(通过体外碱基修饰来实现)。
卡里科进一步研究还发现,体外合成的mRNA通常会污染一定量的双链RNA,而双链RNA也会引发免疫应答,因此她对最初合成的RNA进行纯化,除去双链RNA。这种操作一方面减少了炎症发生,更重要的是极大增加了mRNA在体内的蛋白生成效率,从而解决mRNA应用过程中效率低下的难题。卡里科共发表70多篇论文,绝大多数聚焦于mRNA体外制备方法的改进和完善,解决实际应用过程中面临的诸多问题。
2006年,卡里科和韦斯曼申请了第一个mRNA相关专利——含修饰核苷酸的mRNA制备及应用,主要涉及无免疫原性、包含核苷酸修饰等特性的mRNA(专利号:US 8278036)。迄今为止,她已拥有十几个专利,全部围绕着mRNA制备方法的改进、实用化操作和应用。当年,她与人和合作共同成立了一家生物技术公司——RNARx,尝试开发mRNA药物(主要开发治疗贫血的EPO mRNA),但公司最终于7年后关闭。卡里科期望的mRNA应用热潮并未出现,市场对这项研究并不热衷,因此也少人问津。
2010年,转机再次出现。正在斯坦福大学做博士后的罗西(Derrick Rossi)发现了卡里科的文章,并敏锐意识到这一方法的巨大应用潜力。他成立了一家生物技术公司——也就是Moderna,应用mRNA开发疫苗和药物。与此同时,卡里科也将自己的技术转让给德国一家新兴生物技术公司BioNTech。彼时,BioNTech还蜗居在德国美因茨大学(Mainz university)的校园内,连公司网站都没做起来。
2013年,卡里科与宾夕法尼亚大学又发生一次不愉快,校方拒绝恢复她1995年降薪的教师职位,又在知识产权许可上与她产生分歧(宾大将知识产权卖给了另一家公司)。最终,卡里科选择辞职,加入BioNTech并担任高级副总裁。校方对卡里科极尽刻薄,称BioNTech是一家连网站都不存在、名不见经传的小公司,暗示卡里科的选择毫无价值。
随着mRNA技术在应用过程中的进一步改进,两家公司距离真正的市场成功越来越近。2017年,Moderna开始开发寨卡病毒mRNA疫苗;2018年,BioNTech与辉瑞公司合作开发流感mRNA疫苗,尝试从实验室走向应用。但市场仍不买账,投资者对mRNA疫苗应用前景并不看好,两家公司只能 “艰难度日”。
在这沉默苦闷的研究岁月中,比卡里科出名更早的是她的女儿祖萨娜·弗朗西亚(Zsuzsanna Francia)。也许是继承了母亲坚忍不拔的精神,祖萨娜在2008年北京奥运会和2012年伦敦奥运会上连续夺得了划船比赛冠军。

2012年伦敦奥运会,卡里科夫妇祝贺女儿夺取奥运金牌。Katalin Kariko供图
四 完美救赎
2020年初,新冠肺炎暴发,新冠病毒蔓延全球。
1月11日,中国疾控中心张永振研究团队在病毒学网站(virological.org)公布了新型冠状病毒全基因组序列。
序列刚刚公开,欧美的制药公司就开始研究mRNA疫苗将要使用的序列。
1月13日,序列确定,Moderna开始制作mRNA。
后来的事情,我们都知道了。
在全球多国参与的新冠疫苗开发竞赛中,mRNA疫苗的优势(研发时间短)充分体现,在得到新冠病毒刺突蛋白(S)mRNA信息基础上,快速开启设计、制备、动物实验、临床实验等步骤。11月9日,辉瑞与BioNTech联合宣布,基于Ⅲ期临床结果,其研发的新冠疫苗mRNA BNT162b2有效率超过90%(最终数据显示有效率可达95%);一周后,Moderna宣布,其开发的mRNA疫苗mRNA-1273有效率也接近95%。
当卡里科听到BioNTech三期临床振奋人心的结果后,她的第一反应是:“得救了!我拼命地吸气,我太兴奋了,我真怕我死了……”悬了许久的心终于可以得到些许休息。卡里科希望mRNA疫苗能在随后新冠肺炎预防方面发挥重要作用,并期望mRNA技术能在更多疾病治疗方面得到广泛应用。
现在已经是哈佛大学干细胞研究所教授的罗西认为,如果mRNA疫苗最终在新冠肺炎疫情方面发挥了关键性作用,卡里科和韦斯曼绝对配得上诺贝尔化学奖。
此时距卡里科最初开始研究mRNA已有四十多年,距离她的关键技术突破也有了十五年。


