本文作者:橘灯
世界最贵药物 TOP 10 榜又更新了。
2023 年 6 月 22 日,一款名为 Elevidys 的药物获得 FDA 加速批准。随后,这款定价为 320 万美元(约合人民币 2306 万元)一个疗程的新药迅速跻身上榜,成为了当前全世界第二贵的药。
然而,Elevidys 的面世并没有引起想象中的热烈欢迎,包括 Nature 在内的医疗权威媒体和医学专家对这一药物的前景都持观望态度,研发药企的股价不涨反跌。
Nature 报道将「内部反对」写进了标题
全球第二贵,它如何诞生?
Elevidys 是一款由生物制药公司 Sarepta 和罗氏共同开发的基因治疗药物,用于治疗杜氏肌营养不良(DMD)患者。此次获批后,该药也成为了全球第一个上市的 DMD 基因治疗药物。
DMD 是一种罕见的遗传性肌肉疾病,在婴幼儿中发病率有 1/3300[1],且致残率极高。典型的 DMD 可早在 2~3 岁时即发病,到了 12~13 岁时,患者就只能依赖轮椅生活,平均寿命不足 20 岁[2]。
DMD 由抗肌萎缩蛋白基因的失活突变所引起。在肌肉中,抗肌萎缩蛋白具有保护肌纤维细胞膜、预防运动后肌肉疲劳、阻止钙离子病理性流入肌纤维的作用,而 DMD 患者中抗肌萎缩蛋白的严重缺乏导致了肌纤维的严重变性[3],进而诱发肌肉组织的结构紊乱和功能丧失。
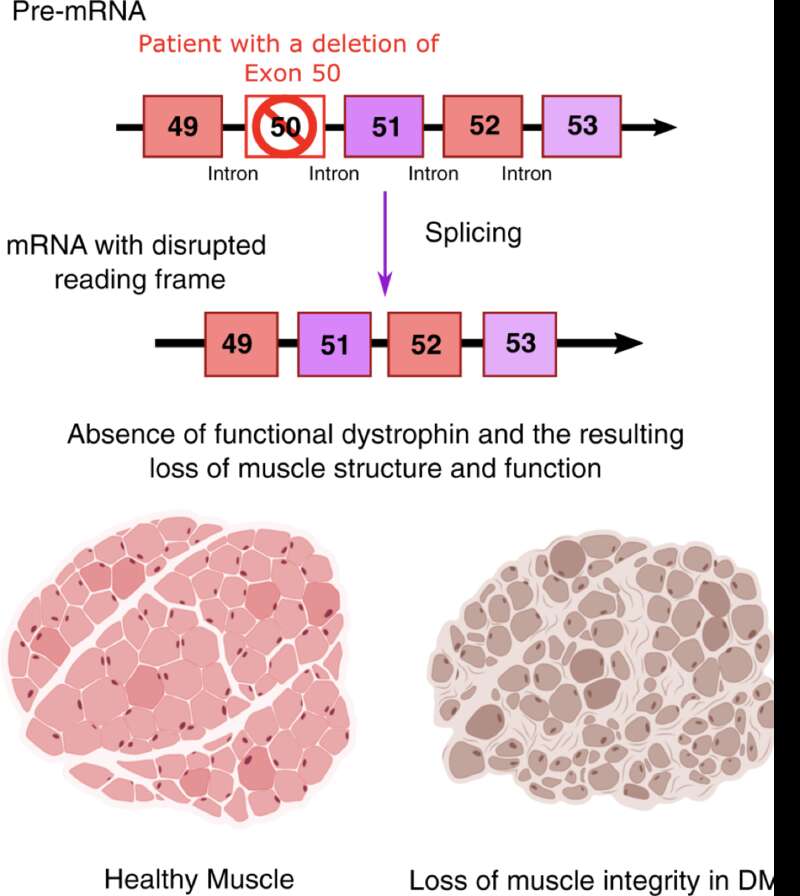
一种常见的抗肌萎缩蛋白基因突变(外显子 50 缺失),导致 DMD 患者的肌肉(图右)结构无序、肌纤维和其他支持细胞难以形成正常的肌肉(图源:参考资料 4)
如何才能治疗这种疾病?
理论上来讲,和其他遗传病类似,如果能够用载体将正常的抗肌萎缩蛋白基因导入到肌纤维中,让肌纤维分泌出正常的抗肌萎缩蛋白,那么患者就有可能恢复正常的肌肉功能。
遗憾的是,这个看似单纯的想法在现实中却遇到了瓶颈:抗肌萎缩蛋白基因是迄今为止最大的人类基因,常用的一些基因治疗载体,例如腺相关病毒(AAV),都无法将完整的该基因携带到其基因组中。
为了攻克这个难题,研究者尝试从老的经验里找新的出路。
早在上世纪 80 年代,就有学者发现,部分 DMD 患者尽管存在基因突变、不能生成完整的抗肌萎缩蛋白,但他们的体内仍然可以合成一种截短的、失去了部分氨基酸片段的抗肌萎缩蛋白,这些蛋白在体内依然可以发挥功能,也正因为如此,这一部分患者的症状和一般患者相比明显要轻[5]。
无法传递完整的基因,就传递一个截断的版本。这成为了 DMD 基因治疗研发的核心思路。最终,研究者们在筛选出了一种功能保存最佳的截短型抗肌萎缩蛋白后,将其基因嵌入 rh74 型腺相关病毒(一种来源于非人灵长类动物的腺相关病毒)载体,万众瞩目的 Elevidys 就此诞生。
加速审批后,疗效受到质疑
作为生物制药公司 Sarepta 的核心产品,Elevidys 自宣布研发起就受到了众人的广泛关注,甚至于全球排名 Top10 的研发型药企巨头罗氏公司,在 2019 年专门给 Elevidys 投资了 11.5 亿美元(约合 83 亿人民币,包括 7.5 亿美元现金和 4 亿美元入股)以支持其研发,还给 Elevidys 定下了随研发进度和销售额而定的最高 17 亿美元里程碑付款[6]。
不仅如此,Elevidys 的研发恰逢基因治疗红利期,这种「极其昂贵但可以一次性治好罕见病」的治疗方式正在被越来越多的患者所接受。从基因治疗机制来看,一旦 Elevidys 获批,几乎所有 DMD 患者都有可能从中获益。
然而,谁都没有想到,Elevidys 获批上市后,等待它的并非想象中的鲜花与掌声,而是现实的狠狠一锤——研发药企 Sarepta 股价应声下跌 11%。
很快,媒体和医疗领域的质疑接踵而至。
首先,是 Elevidys 的疗效。
在 FDA 关于该药上市的专家咨询委员会会议上,专家们以 8-6 的比分勉强通过该药加速上市,这使得该药成为了史上唯一一个没有硬性疗效证据,而是通过加速审评程序上市的基因治疗药物[7]。

FDA 对 Elevidys 的审批文件
而此次加速上市审批中,将替代终点设置为患者骨骼肌中观察到了截短型抗肌萎缩蛋白的表达。有不少批评观点认为,这一终点仅仅意味着 Elevidys 成功将基因导入了肌纤维中并稳定表达,但这种表达和患者的临床症状的改善是否有关,目前尚无有力的证据。
而在该药的 II 期临床试验中,治疗组患者第 12 周的肌肉活检显示,肌纤维抗肌萎缩蛋白水平已经达到了正常人的 40% 左右;但在第 48 周的行走能力评价量表中,治疗组和安慰剂组的分数则并无差异。进一步分析则显示,Elevidys 成功提高了 4~5 岁儿童的行走能力,但对 6~7 岁儿童则并无效果[7]。
也正因如此,FDA 对 Elevidys 的审批才加上了 4~5 岁这样一个严格的年龄限制[8],且预想中的完全批准则转为了加速批准。
2300 万一个疗程,但不一定能挣到钱
伴随着质疑和争议,研发药企公布了 Elevidys 的定价:320 万美元一个疗程(约合人民币 2306 万元)。
这个价格挤掉了定价 300 万美元/疗程的 Skysona(肾上腺脑白质营养不良的基因治疗药物),成为当前全世界第二贵的药物,仅次于去年获批上市的 350 万美元/疗程的 Hemgenix(乙型血友病的基因治疗药物)。
然而,这个高昂的价格究竟能带来多少收益,市场分析并不乐观。
有报告预计,今年可能只有 9 名患者可以接受 Elevidys 的治疗;另一分析则预测,今年内将有 59 名患者用上 Elevidys,总销售额约为 1.17 亿美元(约合人民币 8.4 亿元)——这和此前设定的 17 亿美元里程碑销售额,还有很大距离。
Elevidys 的处境并非个例,实际上,不少价格昂贵的药物都没有想象中的能「挣钱」。
目前,在全球药物价格榜单中,排名 TOP 5 的无一例外均为基因治疗药物。
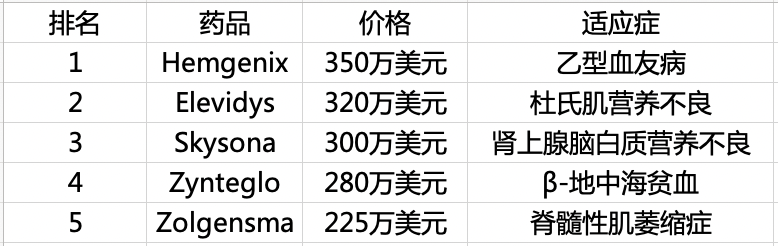
目前全球药物价格 TOP 5(图源:自己制作,根据 FiercePharma 2023 年最贵药物报告整理)
尽管基因治疗理论上可以一次性治愈疾病,但在大多数时候它也并非不可替代。
例如治疗乙型血友病的 Hemgenix,美国的大部分商业医疗保险公司宣布不报销该药费用,或者仅限于为市面上所有药物均难治且预期寿命足够长的患者报销。相对保险全面覆盖的凝血因子替代疗法来说,没有展现出压倒性的竞争力。
其次,对于大多数基因治疗药物而言,所能覆盖的患者群体本身就比较少,真正能用上这个药的更是少之又少。
例如刚刚获批的 Elevidys,由于适应症被从原定的 4~7 岁缩短至 4~5 岁,加上 FDA 要求该药使用前必须筛查抗 AAVrh74 抗体,这就导致该药适用的患者锐减至每年约 400 人。
不仅如此,基因疗法目前仍然是一个风险与收益并存的领域。
以 Elevidys 采用的 AAV 为例,有研究[9]统计,健康人对 AAV6 产生抗体的概率高达 40%,如果对已经存在抗 AAV 抗体的患者进行基因治疗,将存在疗效丧失乃至严重免疫不良反应的风险[10][11]。此外,多种 AAV 本身就在人体内具有强烈的免疫原性。
去年 10 月,美国一名 27 岁的晚期 DMD 患者在临床试验中接受了以 AAV 为载体、利用 CRISPR-Cas9 基因编辑技术来重编辑抗肌萎缩蛋白基因的疗法后,8 天后因脑损伤和多器官衰竭离世。
尸检结果表明[12],研究人员错估了患者残余的肌肉体积从而过量给予了药物,大量载体病毒在患者体内诱发了毛细血管渗漏综合征,并迅速使患者出现急性呼吸窘迫综合征,最终死亡。
此前另一家公司使用 AAV9 作为载体的 DMD 基因治疗药物临床研究中,一名患者接受载体病毒注射后,免疫系统产生了针对载体病毒衣壳的免疫反应,进而攻击心肌细胞,引起心源性休克和心力衰竭,最终不治身亡。这款药物也因此被 FDA 叫停研发 4 个月。
以上种种因素,让基因治疗药物在销售和推广中受到影响。不过,基因治疗中也并非没有盈利的特例,脊髓性肌萎缩的基因治疗药物 Zolgensma 就成为了诺华意料之外的盈利焦点。
作为世界第四贵的药物,一个疗程的 Zolgensma 定价 225 万美元,该药上市后第一季度销售额就达到了 1.6 亿美元,2021 年销售额高达 13.51 亿美元,2022 年销售额进一步上涨到 13.7 亿美元[14],甚至比同样治疗脊髓性肌萎缩的口服药物利司扑兰(2022 年销售额 11.73 亿美元)更高。
Zolgensma 之所以如此畅销,一方面因为脊髓性肌萎缩是罕见病中相对常见的一种,患者数量较多;另一方面,Zolgensma 治疗较为简单且不良反应较小。
回到刚刚获批的 Elevidys 身上,尽管前景尚不确定,但研发药企表示,将继续进行 III 期临床试验,尽快扩大适应症范围。药企还表示,Elevidys 的定价甚至可以达到 500~1300 万美元,在这样的价格下,该药才将具有「成本效益(be cost-effective)」。


