今天下午,2022年诺贝尔奖的最后一个自然科学奖项终于揭晓。美国Scripps研究所的K. Barry Sharpless教授、丹麦哥本哈根大学的Morten Meldal教授以及美国斯坦福大学的Carolyn R. Bertozzi教授分享了诺贝尔化学奖的桂冠。其中,Sharpless教授、Meldal教授 因在点击化学(click chemistry)研究中做出的卓越 贡献获奖,Bertozzi教授则因开拓生物正交化学(bioorthogonal chemistry)领域而获奖。

▲今年的诺贝尔化学奖得主Carolyn R. Bertozzi教授(左)、Morten Meldal教授(中)和K. Barry Sharpless教授(右)(图片来源:诺贝尔奖官网)
值得一提的是,这也是Sharpless教授在2001年因手性催化氧化反应获诺贝尔化学奖以来,第二次摘得诺贝尔化学奖的桂冠。历史上,两获诺贝尔化学奖的情景只发生过一次(Frederick Sanger教授,1958年与1980年)。Bertozzi教授也是第八位诺贝尔化学奖女性得主。接下来,我们将分别解读这三位科学家的杰出成果。

▲Carolyn Bertozzi教授的工作将点击化学推进到了一个全新的领域,并将其应用到了生命体中,她的生物正交反应能在不干扰细胞正常化学的情况下发生。而Barry Sharpless教授与Morten Meldal教授奠定了一类全新化学形式的基础——点击化学,它能让分子模块快速、高效地拼在一起。(图片来源:参考资料[1])
划时代的“点击化学”
大自然是人类最好的老师,生物体内的蛋白质、核酸(DNA、RNA)大分子为生命的正常运转与延续提供了重要的保障。尽管这两种大分子的种类繁多复杂,但组成其结构的基本单元却很精简。蛋白质的基本结构单元为氨基酸,核酸则为核苷酸,前者有20种,后者只有5种。但这些结构单元可以通过不同的次序、空间取向进行排列,得到成千上万种行使不同功能的生命大分子,进而形成我们眼中的大千世界。这种组合方式有些像乐高玩具,基础模块的种类并不多,但可以凭借丰富的想象力搭建出变化无穷的造型。

▲很多生物大分子的结构就像乐高玩具,造型千变万化,基础模块的种类却并不多(图片来源:123RF)
乐高积木可以通过一个模块的凹槽与另一个模块的凸起契合完成两个组件的拼接。类似的,化学家也希望找到一种合适的“分子接口”,众多分子中只要这两种基团相遇,便可以像搭扣一样“click”(咔嗒)一声将两种分子紧锁在一起。如此一来,小分子砌块只需要分别修饰这些咬合接口,便可以实现两两拼接,进而构建复杂结构的大分子。
时间回到2001年。就在Sharpless教授第一次荣膺诺贝尔化学奖的四个月前,他的另一篇重磅论文发表在了知名期刊Angewandte Chemie International Edition上。在这篇论文中 ,他与同事们写道: “考察自然界的分子,表明相比碳-碳键,自然界更喜欢碳-杂原子键。 ”无论是核酸、蛋白质、还是多糖,都是由小型分子通过碳-杂原子键拼接起来的,而这些小型分子的总数量仅在35个左右。如果人类能将这套法则学到手,就能快速并可靠地合成大量有用的分子……

▲这篇论文目前已被引用超过14000次(图片来源:参考资料[2])
于是,点击化学(click chemistry)的概念应运而生,其强调以碳-杂原子键键合的方式进行分子组合,与此同时反应需具备产率高、适用性广、副产物无害等特点,这也正符合Sharpless教授一直倡导的“简单而有用的化学”。
通常我们所说的点击反应,即是指1,3-偶极环加成反应,又叫作Huisgen环化反应。该反应最早由德国化学家Rolf Huisgen教授(已于2020年去世,享年100岁)提出,他发现炔烃与叠氮化物混合时可发生[3+2]环化,从而得到五元杂环化合物。不过,这一反应需要在高温条件下进行,并且以不对称的炔烃作为底物时,经常会出现两种区域异构体混合物。显然,分子在反应体系中“煮”一遍,很多敏感的官能团会出现不兼容的现象,由此便限制了底物的适用范围。加上得到的产物为混合物,效率较低,也为后续分离带来了麻烦,并不符合点击化学的理念。
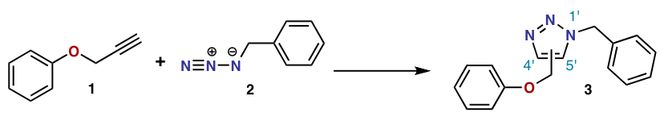
▲Huisgen环化反应:一个经典的“点击化学”反应(图片来源:By Greginnd [Public domain], from Wikimedia Commons)
但这个问题可通过使用Cu(I)催化剂得以解决。2002年,Sharpless教授与Fokin教授合作报道了Cu(I)催化末端炔烃与叠氮化物的环加成反应。同年,Meldal教授也将末端炔烃负载在树脂基底上,在Cu(I)催化剂的作用下实现了其与叠氮化物的环化。这两项工作使得反应在室温条件下便可进行,且具有良好的区域选择性,最终主要得到单一的环化产物,成功实现了对Huisgen环化反应的改良。
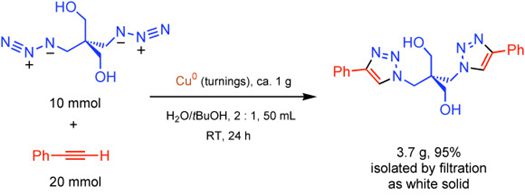
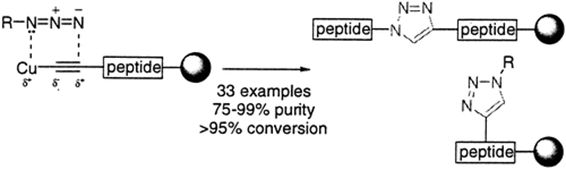
▲Sharpless教授与Fokin教授的工作(上),以及Meldal教授的工作(下)(图片来源:参考资料[3])
这类反应的底物适用范围十分广泛。将炔烃与叠氮化物的取代基进行适当的变换,便可以实现多种不同分子的构建。目前,点击反应已在药物研发、功能材料、超分子自组装、化学生物学等诸多领域得到广泛的应用。毫不夸张地讲,该反应就是人们一直寻找的那种“分子接口”,改变了合成复杂结构分子的命运。
“(2001年)诺贝尔奖证书上的墨印还没有干透,他就提出了点击化学的概念和实例。这一概念在化学和化学生物的偶联反应中,已经占据了统治性的地位。”在Sharpless教授斩获2019年美国化学会最高荣誉普里斯特利奖章(Priestley Medal)时,科学家们就已对点击化学的重要意义做了很好的总结。今日点击化学获得诺贝尔化学奖的垂青,可谓实至名归。两位作为该领域代表的杰出科学家得此殊荣,也是对他们贡献的最好认可。
生物正交化学
自然界中,生物体内发生的化学过程吸引了化学家和生物学家的共同兴趣。然而,构成生命的基本单元——细胞,是一个极其复杂的系统,时刻发生着无数反应,要在活体内研究核酸、脂质、蛋白质等众多生物分子极具挑战,尤其是,如何在不受任何其他过程干扰的情况下研究目标分子。

▲2008年,开发GFP的三位科学家同样获得了诺贝尔化学奖(图片来源:The Nobel Prize in Chemistry 2008. NobelPrize.org. Nobel Media AB 2019. Tue. 8 Oct 2019.)
化学和生物交叉领域的一些科学家为此开发新工具和方法,一个典型的例子就是我们已熟悉的发光蛋白(例如绿色荧光蛋白GFP)。以基因编码的发光蛋白作为标签,与感兴趣的蛋白相连,让我们看到蛋白的运动、定位、相互作用等。发现和发展GFP的三位科学家也因此在2008年荣膺诺贝尔化学奖。
不过,还有很多生物分子,以及分子各种各样的修饰,很难用基因编码的报告分子来示踪,需要发展其他的手段实现多聚糖、脂质、核酸等生物分子的标记。
生物正交化学的概念便是在这样的背景下产生的。这类反应要求在研究活体生物系统内给定的化学反应时,不会干扰其中固有的生物化学过程,即不产生细胞毒性。 发展该反应的目的不仅在于充分理解生物体内已知的反应,更是为了发现其中的新反应。 正如Carolyn Bertozzi教授在2011年Accounts of Chemical Research期刊的一篇文章中总结回顾:
“生物正交反应可以帮助人们更准确地理解生物化学反应过程中分子层面的细节,而要在如此复杂的环境下研究生物分子,就需要引入相应的成像探针、亲和性试剂或者具有特定功能的基团。 ”

▲2011年发表的综述文章概述了生物正交化学十余年发展的历程(图片来源:参考资料[7])
Bertozzi教授在这一交叉领域做出的开拓性贡献与她的经历分不开。 她在哈佛大学获得化学学士学位后,在加州大学伯克利分校完成化学博士研究,专注于低聚糖类似物的化学合成。 低聚糖是一类结构多样的分子,在细胞识别和细胞结合中发挥重要作用。 细胞表面的糖链分子可以用于免疫系统过程,有助于识别细菌和病毒感染。 顺理成章地,在博士后期间,Bertozzi教授进入免疫学领域,关注与促炎反应有关的细胞粘附,积累了大量关于细胞生物学的知识。 因为在细胞相互作用方面做出的贡献,1999年,33岁的她成为麦克阿瑟天才奖历史上最年轻的获奖者之一。
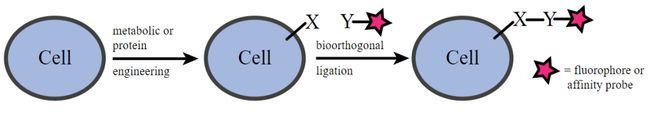
▲生物正交反应的示意图(图片来源:public domain)
在此基础上,Bertozzi教授开始寻找适合不同类型生物分子的标记方式。生物正交反应的基本策略,是将细胞或生物体与修饰特定功能基团的前体分子(化学报告分子)共同孵育。这种前体分子可以是用于标记多聚糖的单糖、标记核酸的核苷酸、标记蛋白质的氨基酸以及标记脂质的脂肪酸等。 一旦化学报告分子引入目标生物分子中,就可以利用探针分子对其进一步处理,研究给定的生物化学过程。 由于细胞内主要的介质为水,该类反应需要能在水作为溶剂的条件下进行。 同时,目标生物分子在生物体内浓度通常较低,化学报告分子在此情况下仍具备顺利结合靶标分子的能力,并满足一定的反应速率。
Bertozzi教授发展的生物正交反应借鉴了Staudinger还原(Staudinger Reduction)反应,该反应最早由德国化学家Hermann Staudinger先生提出,叠氮化物与有机膦或亚磷酸酯反应得到氮杂叶立德(aza-ylide)中间体,进一步水解便可形成相应的胺类产物。这两类物质在生物体内并不存在,因此不会与其他生物分子发生反应。此外,叠氮基团体积小,可以最小程度地影响被修饰的目标生物分子,更真实地还原生物化学过程。
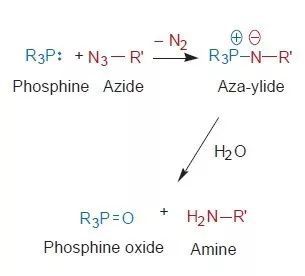
▲经典的Staudinger还原反应的过程(图片来源:参考资料[8])
于是,他们设计了Staudinger连接(Staudinger Ligation)反应,其反应过程如下图所示: 三芳基膦1的其中一个芳香基团邻位修饰一个酯基,同时标记了探针基团。 修饰叠氮基团的目标生物分子与之反应后形成氮杂叶立德中间体2,酯基进而捕获该中间体发生分子内环化,形成相应的内酰胺中间体3,随后在水性环境下水解得到最终酰胺基修饰的靶标分子4。 内酰胺中间体3可谓该反应的核心,常规的Staudinger还原反应在得到氮杂叶立德中间体2后直接水解得到氨基修饰的靶标分子,无法引入探针基团。
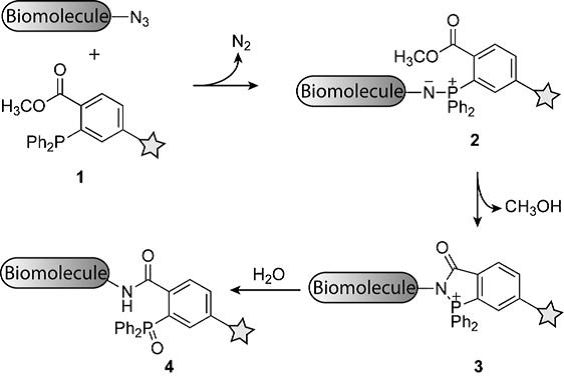
▲生物正交反应Staudinger连接反应的过程(图片来源:参考资料[9])
有了以上工作的启发,许多研究者纷纷加入到生物正交反应的研究中。一系列不同的生物正交反应相继涌现,并在蛋白质、多聚糖、脂质、核酸等生物分子的选择性标记中得到了广泛的应用。毫不夸张地讲,生物正交反应的提出为生物体内原位研究生物化学过程提供了重要的手段,具有划时代的意义。
如今,Carolyn R. Bertozzi教授作为该反应的重要开拓者。摘取诺贝尔化学奖的桂冠,也同样是对其在化学生物学中贡献的最好褒奖。
参考资料:
[1] The Nobel Prize in Chemistry 2022, Retrieved October 5, 2022, from https://www.nobelprize.org/uploads/2022/10/press-chemistry2022.pdf
[2] Hartmuth C. Kolb et al., (2001), Click Chemistry: Diverse Chemical Function from a Few Good Reactions, Angewandte Chemie International Edition in English, DOI: 10.1002/1521-3773(20010601)40:11%3C2004::AID-ANIE2004%3E3.0.CO;2-5
[3] Vsevolod V. Rostovtsev et al., (2002). A Stepwise Huisgen Cycloaddition Process: Copper(I)-Catalyzed Regioselective “Ligation” of Azides and Terminal Alkynes. Angew. Chem. Int. Ed., DOI: 10.1002/1521-3773(20020715)41:143.0.CO;2-4
[4] Christian W. Tornøe et al., (2002). Peptidotriazoles on Solid Phase: [1,2,3]-Triazoles by Regiospecific Copper(I)-Catalyzed 1,3-Dipolar Cycloadditions of Terminal Alkynes to Azides. J. Org. Chem., DOI: 10.1021/jo011148j
[5] American Chemical Society names K. Barry Sharpless 2019 Priestley Medalist, Retrieved October 7, 2020, from https://www.acs.org/content/acs/en/pressroom/newsreleases/2018/june/acs-names-k-barry-sharpless-2019-priestley-medalist.html
[6] Dr. Carolyn Bertozzi pioneers bioorthogonal chemistry to study molecules within living systems. from https://www.ipwatchdog.com/2017/10/05/evolution-of-tech-dr-carolyn-bertozzi-invents-bioorthogonal-chemistry-to-study-molecules-within-living-systems/id=88882/
[7] Carolyn R. Bertozzi et al., (2011) A Decade of Bioorthogonal Chemistry. Acc. Chem. Res., DOI: 10.1021/ar200193f
[8] Eliana Saxon et al., (2000) Cell Surface Engineering by a Modified Staudinger Reaction. Science, DOI: 10.1126/science.287.5460.2007
[9] Ellen M. Sletten et al., (2009) Bioorthogonal Chemistry: Fishing for Selectivity in a Sea of Functionality. Angew. Chem. Int. Ed., DOI: 10.1002/anie.200900942


