海外网10月4日电 北京时间10月4日17时30分,2021年诺贝尔生理学或医学奖揭晓。奖项授予美国科学家戴维·朱利叶斯(DavidJulius)和阿代姆·帕塔博蒂安(Ardem Patapoutian),以表彰他们在“发现温度和触觉感受器”方面作出的贡献。两位科学家在各自独立的研究中发现了人体感知温度、压力及疼痛的分子机制,为与触觉相关的生理疾病研究提供了重要依据。

戴维·朱利叶斯(David J. Julius),美国生理学家。他是加利福尼亚大学旧金山分校教授。2004年入选美国科学院院士。2010年因对辨认涉及伤害性作用的离子通道的研究获邵逸夫奖。同年也获得阿斯图里亚斯亲王奖科学技术奖。2017年获加拿大盖尔德纳国际奖。
阿代姆·帕塔博蒂安(Ardem Patapoutian),是加利福尼亚州拉霍亚市斯克里普斯研究所的一名亚美尼亚裔分子生物学家和神经科学家。帕塔博蒂安在1986年移居美国之前就读于贝鲁特美国大学。1990年,他获得了加利福尼亚大学洛杉矶分校的细胞与发育生物学学士学位,并获得了博士学位。 1996年从加州理工学院获得生物学博士学位。
为什么会辣得“菊花痛”?今年的诺贝尔生理学或医学奖给了你答案
2021年诺贝尔生理学或医学奖授予大卫·朱利叶斯(David Julius)和阿登·帕塔普提安(Ardem Patapoutian),“因为他们发现了温度和触觉的感受器。( "for their discoveries of receptors for temperature and touch.")


想象一幅美好的场景,你正躺在海滩上,温暖的阳光洒在身上,海风轻抚脸颊,粗糙的沙粒摩擦着皮肤,然后你拿了一颗薄荷糖含在嘴里,感到一阵清凉……
这些都是我们熟悉的感觉,虽然我们感受起来似乎截然不同,但它们都与我们的躯体感觉有关。无论有什么东西让你觉得热或冷,硬或软,疼痛或压迫等等,都是躯体感觉系统在帮助辨别这些刺激。
在分子水平上,我们对躯体感觉了解不深。温度、压力等物理属性,究竟是如何被探测并转化为大脑可处理的信号,一直是个神秘的问题。它吸引着许多生物学家和神经科学家,戴维·朱利叶斯(David Julius)和阿代姆·帕塔博蒂安(Ardem Patapoutian)就是其中杰出的代表。在过去的20多年间,他们分别独立发现了温度感受器和压力感受器,为温度感知和机械感知提供了分子和神经基础,从而引领了神经科学领域的一场“变革”,并为人类生理和疾病提供了新的见解。
由于朱利叶斯和帕塔博蒂安二人开创性的发现,他们被授予了2021年诺贝尔生理学或医学奖。

加州大学旧金山分校的戴维·朱利叶斯(右)和斯克里普研究所的阿代姆·帕塔博蒂安(左),在独立研究中分别发现了温度和压力的感受器。朱利叶斯和帕塔博蒂安身上有一些相似之处。严格说来他们都有移民背景。帕塔博蒂安于1967年出生在黎巴嫩,他的童年经历战火和动荡,19岁时来到美国定居洛杉矶。朱利叶斯的祖父母当年为了逃离东欧的反犹太主义,从东欧移民美国,朱利叶斯于1955年在纽约出生。| 图片来源:kavliprize.org

事实上,从神经层面来看,我们的大多感官可以简化地理解成“接受刺激 - 传递信号 - 大脑接收并做出反应”。比如,我们的嗅觉和味觉都是种化学检测系统,视觉则是通过感受光的刺激来形成信号。触觉、疼痛等躯体感觉也在外部环境的刺激下产生反应。
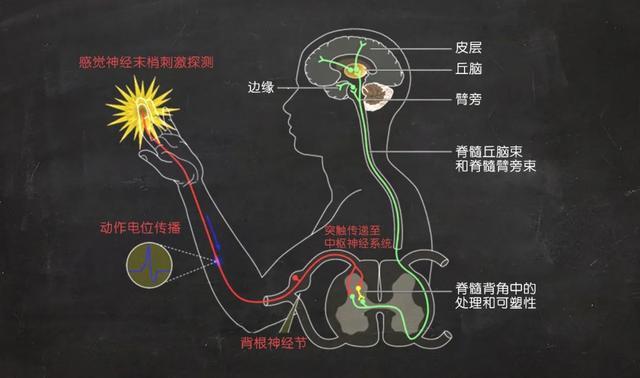
外部环境刺激(如高温和压力)激活感觉神经膜上的离子通道受体,产生电脉冲,电信号通过背根神经节(DRG)到达大脑的感觉区域。| 图片来源:kavliprize.org
这个过程需要一类被称为感受器(receptor)的结构的帮助。我们可以把感受器理解成“锁”或者“门”,它们在特定情况下才会被激活,就像锁需要特定钥匙才能打开一样。
我们能尝出苦味,是因为负责苦味的味觉感受器在遇到形状和化学成分都符合要求的分子时,它们就会打开,经由一条通路向大脑传递信号,因此大脑就收到了“好苦啊”的信息。
在味觉上,我们已经发现了负责咸、甜、酸、苦、鲜5种基本味道的感受器,也有一些更前沿的研究暗示了更多基本味道的可能。然而在所有味道中,有一种绝对与众不同,那就是辣味。严格说来,辣并不是一种“味”。这就与朱利叶斯的突破性发现密不可分。

提到辣的东西,我们都会有一种“热”的感觉,红辣椒会让你嘴巴感觉灼烧,吃完辣椒第二天“身体末端”很有可能也会经历火辣辣地疼。神奇的是,还有一些东西会让我们觉得“冷”,比如薄荷。
辣椒中的辣味来自一种叫辣椒素的物质。早先,一些科学研究表明,在辣椒素和高温的刺激下,一部分感觉神经元变得活跃。然而,关于其作用的具体机制一直存在争议。直到1997年,朱利叶斯在感受疼痛的神经元上识别出了受体分子TRPV1,并证明它能被高温和辣椒素激活,才揭开了答案。而这也解释了辣总是和热联系在一起的原因。
TRPV1属于一个离子通道家族,它位于细胞膜上,一旦激活就会打开,让带电离子(如钠和钙)流入细胞。它广泛地分布在我们身上,这就是为什么辛辣的食物在进出身体的过程中都会带来灼热的感觉。
TRPV1是第一个在脊椎动物身上被确认生理功能的TRP通道,可以说是理解触觉和痛觉的分子基础的一个里程碑,让我们认识到物理力激活神经元的机制。
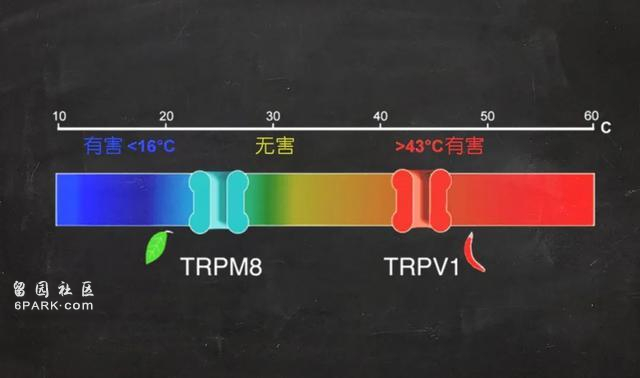
TRP通道作为热感受器。| 图片来源:kavliprize.org
随后,TRP通道在温度感知中的作用得到进一步确认。朱利叶斯和帕塔博蒂安分别独立确认了TRPM8是一种会对薄荷醇和寒冷产生反应的分子。现在越来越多发现表明,TRP家族在进化史上是一个非常古老的体系。人们也认识了更多家族成员,包括“芥末感受器”TRPA1、会被百里香等香料激活的TRPA3等等。
朱利叶斯的进一步研究还揭示了,TRPV1对炎症过程中产生的化学物质很敏感,与炎症相关的疼痛敏感反应有关,这为癌症疼痛和其他疾病的治疗开辟了新的潜在途径。

然而,帕塔博蒂安在开始思考我们如何感受外部环境刺激时,他选择了一个不同的研究方向。
2010年,他的团队发现了两个新的离子通道,它们会被机械压力(用细棒轻轻戳)激活,产生电活动。这两个离子通道被命名为PIEZO1和PIEZO2。这个名字来自希腊语中的“piezi”,意为“压力”。
这项突破同样开启了一片全新的领域。在感觉神经元和其他细胞上发现的PIEZO1和PIEZO2,引领了大量新研究,让人们逐渐认识这些离子通道在触觉、疼痛、血压调节和本体感觉等各方面压力感知中的作用。
其中或许最令人感到新奇的要数与本体感觉相关的研究。本体感觉是指我们感知身体在空间中位置的能力。这种感觉让我们能够站立和行走,甚至闭上眼睛或蒙上眼睛后依旧能行走自如,它依赖的是那些向大脑发出肌肉伸展信号的神经元。
帕塔博蒂安的团队和其他研究已经证明,PIEZO2是本体感觉相关的关键分子。有研究称,罕见的PIEZO2缺乏的人,在黑暗中站立和行走都有困难。帕塔博蒂安更近期的研究,在人类遗传学和小鼠模型上已经证明,PIEZO1在控制红细胞体积中会发挥作用。他发现了一种PIEZO1基因的变异,似乎可以防止疟原虫感染。
帕塔博蒂安在接受采访时曾表示,他的研究生涯中也曾经历过很长一段时间进展缓慢的阶段,他甚至曾经想过转行。但幸好他坚持了下来。“这是一段非常迷人的旅程,PIEZO带我们从生物学和病理生理学,接下来又会带着我们前往新的未知的领域。”
今年诺贝尔奖获奖者的研究 可能会让我们找到治疗疼痛的新方法
新京报快讯(记者 向晨雨)北京时间10月4日下午5点34分许,2021年诺贝尔奖的首个奖项——生理学或医学奖揭晓,两位科学家戴维·朱利叶斯(David Julius)和阿登·帕塔普蒂安(Ardem Patapoutian)被授予这一奖项,以表彰他们在人类感知疼痛和温度的机制研究方面所做出的贡献。两名科学家将分享1000万瑞典克朗(约合人民币736万元)奖金。
BBC报道指出,他们的这一研究可能会让我们找到治疗疼痛的新方法。

诺贝尔奖官网截图
诺贝尔奖官网针对这一奖项的最新公告表示,感知温度和各种触觉的能力对于我们的生存至关重要,这也是我们与周围世界互动的基础。我们在日常生活中通常认为这是理所应当的,但今年的获奖者解决了我们在感知温度和压力的过程中,神经系统是如何运作的这一问题。

诺贝尔奖官网截图
此前外界普遍认为,mRNA技术研究背后的两位科学家卡塔林·考里科(Katalin Karikó)和德鲁·魏斯曼(Drew Weissman),会是今年诺贝尔奖获奖者的最有力人选,这一mRNA技术研究是目前多款新冠疫苗的制造基础。这两位科学家此前已获得今年的拉斯克奖(Lasker Awards)和突破奖(Breakthrough Prizes),以往这两项医学领域大奖的获奖者中,很多都会继而获得当年的诺贝尔奖。
2020年诺贝尔生理学或医学奖被颁给发现丙型肝炎病毒的三位科学家,2019年这一奖项的三位获奖者革命性地发现了细胞在分子水平上感知氧气的基本原理。
诺贝尔奖由瑞典发明家、企业家阿尔弗雷德·诺贝尔的遗嘱设立,自1901年开始颁发。受新冠疫情影响,今年延续去年的举办方式,各奖项的获奖者在各自国家获颁奖牌和证书,颁奖仪式通过电视、网络进行现场直播。另外颁奖晚宴也和去年一样被取消,以往每年的诺贝尔奖项公布后,都在诺贝尔的逝世纪念日——12月10日举办颁奖晚宴。
未来几天,还有5项奖项将揭晓。诺贝尔物理学奖将于北京时间10月5日17时45分公布;诺贝尔化学奖将于北京时间10月6日17时45分公布;诺贝尔文学奖将于北京时间10月7日19时公布;诺贝尔和平奖将于北京时间10月8日17时公布;瑞典央行纪念阿尔弗雷德·诺贝尔经济学奖将于北京时间10月11日17时45分公布。
新京报记者 向晨雨
两位美国科学家获诺贝尔生理学或医学奖 他们研究了什么?

2021年诺贝尔生理学或医学奖得主
加州大学旧金山分校教授David Julius
图源:physiology.ucsf.edu

2021年诺贝尔生理学或医学奖得主
Scripps研究所教授阿德姆·帕塔普蒂安(Ardem Patapoutian)
▼
刚刚,瑞典卡罗琳医学院宣布,将2021年的诺贝尔生理学或医学奖颁给美国旧金山加州大学(UCSF)的教授David Julius和Scripps研究所的Ardem Patapoutian,奖励他们对感知温度与触觉受体的发现。
2020年,《知识分子》曾报道两位科学家同获科维理奖,今日重发。另附《知识分子》特约文章,梳理了David Julius发现Trp离子通道的过程以及该领域的研究现状。
撰文 | 辛玲
● ● ●
神经感知温度和压力的秘密
加州大学旧金山分校的戴维·朱利叶斯和Scripps研究所的阿德姆·帕塔普蒂安在各自独立的研究中发现了人体感知温度、压力及疼痛的分子机制,为与触觉相关的生理疾病研究提供了重要依据。
感知外界刺激的分子受体是人类五大感官系统的生物学基础。虽然我们很早就发现了与视觉、嗅觉相关的分子受体,但对于触觉—包括人体对温度(冷暖)、机械力(如握手)、伤害性物质(如吃辣椒产生疼痛感)的感知却始终是个谜。
生物学家饶毅曾撰文介绍(见饶毅:国产博士的记录),1980年代,朱利叶斯开始用当时比较新的方法表达克隆寻找五羟色胺的受体,十几年后,他继续用这一办法寻找辣椒素(辣椒中的一种化合物,可引起灼痛感)的受体,并在1997年找到了一个辣椒素激活的蛋白质分子VR1,而且发现VR1可被加热所激活,因为辣椒素已知与痛觉通路有关,所以这一工作也揭开了温度感受的机理和痛觉的外周感受的部分机理。在1997年的这篇文章中,朱利叶斯也确认VR1属于TRP通道家族,而TRP基因早在1969年就在果蝇中首次发现,只是人们一直不知道它的功能。因此,饶毅评论说,朱利叶斯虽然不是第一个发现TRP基因的科学家,但他发现TRP基因编码的蛋白质在感觉系统起重要作用(温度、压力等)。“把他(Julius)和Ardem合起来是因为他们在压力感觉都有贡献。其中对于长期悬而未决的听觉,他们和其他人都有直接或间接贡献。”饶毅说。
清华大学药学院研究员肖百龙告诉《知识分子》,朱利叶斯的小组后来还陆续发现了这个家族的其它受体,譬如凉爽受体以及芥末油受体。这一新发现的TRPV1及相关通道目前已成为新型止痛药研发关注的靶点。
“David Julius的工作是非常系统的,从发现外周感受疼痛的受体,一直到它的结构和功能上的关系,包括生理上通过基因敲除的技术去研究其他的受体,这是一个系列的工作,David Julius获奖我觉得是well deserved。 ”北京大学生命科学学院研究员李毓龙评论说。
帕塔普蒂安与朱利叶斯几乎同时在研究触觉受体的问题。 帕塔普蒂安在发现了凉爽(薄荷素)、芥末油以及温热的受体后,决定对更具挑战性的机械力受体的寻找发起冲击。 机械力的研究极其困难,一是需要找到合适的刺激方式,二是很难记录产生的电流。
帕塔普蒂安课题组的博后Bertrand Coste寻找到一种可在实验室培养皿中生长的胶质瘤细胞系的细胞,这些细胞通过产生电信号来响应轻触带来的压力变化。 然后从人类的2万多个编码基因中精心挑选出300多个在该种细胞中高表达的候选基因,然后培养逐一缺少(敲低)这些基因的细胞。 接着对样本们进行逐一测试,寻找缺失时会导致细胞失去感应电流的基因。 经过三年多的不懈努力,最终确定清单上的72号候选基因确定具此功能。 他们把这个基因取名为PIEZO,在希腊语里是压力的意思。 PIEZO在动物和植物体内都存在,在进化上高度保守,提示它在功能上非常重要。
同时期在帕塔普蒂安课题组从事博士后研究的肖百龙博士见证了这一激动人心的发现过程,并在后续的研究中证明了PIEZO蛋白形成一类全新的压力敏感离子通道。 肖百龙指出: “寻找压力受体的过程充满了风险,候选基因list有可能是不完整的,敲除过程也可能出现技术问题,但是持之以恒的努力最终收获了这一里程碑式的科学发现”。
帕塔普蒂安很快确认了PIEZOs为哺乳动物体内压力感应的必需基因。他的研究表明,PIEZOs可形成离子通道,它们直接负责皮肤内默克尔细胞(Merkel cells)和触觉终端,以及本体感受器(感觉神经末梢位于肌肉内的感受器,可以感受身体在空间的位置、姿势和运动并做出反应)的压力感测。
PIEZOs 还能通过分布在血管和肺部的神经末梢感知压力,并影响红细胞体积、血管生理,引发多种人类遗传疾病。 PIEZOs的发现打开了力学生物学的大门,这是一个与生物学、工程学和物理学交叉的新兴科学领域,侧重于研究细胞和组织的物理作用力和力学特性的变化如何对健康和疾病造成影响。
“Ardem是一位极其聪明、具有前瞻视野的科学家,但他从不满足于现有成就,不断探索,充满创新欲望。 他对课题组的研究人员充满信任,总是全力支持他们探索前沿科学问题。 他因PIEZO通道的发现和研究获得此次科维理奖确属实至名归。 ”肖百龙说。
“两位获奖者在外周感知分子机制的研究中做出了系统性、里程碑式的贡献,此次获奖实至名归。” 李毓龙表示。他认为,他们的获奖再次表明,卓越的基础科学需要时间积累和好奇心的驱动,而这些正是中国科学家们积极努力的方向。
注:上文摘自2020年《知识分子》文章:7位科学家获科维理奖,但颁奖典礼要到2022年了。
附:TRP通道的前世今生
撰文|齐昕 李婕 卢剑飞
审核|徐天乐 朱曦 李海涛
责编|陈晓雪
● ● ●
细胞的信号转导依赖细胞膜上的多种受体蛋白。而在这其中,离子通道对于即时感知细胞内外信号,调节适应性变化具有关键作用。2003年,Peter Agre和 Roderick Mackinnon 就因为发现了水通道和解释了电压门控钾通道离子选择性原理而共同获得了诺贝尔化学奖。
我们今天介绍的瞬时受体电位(Transient receptor potential ,TRP)通道,也以其复杂的调控机制和丰富的生理功能吸引了一代又一代的科学家为之努力探索。
1
一个意外收获
相比于我们对电压门控型离子通道的研究,对TRP通道的研究起步时间较晚。
1969年,英国爱丁堡大学动物系的 D. J. Cosens 和 Aubrey Manning 在黑腹果蝇上利用甲基磺酸乙酯(Ethylmethane sulfonate,EMS)作为诱变剂,通过人工诱变的方式筛选到一个突变体,该品系存在异常的趋光性和视网膜电位,持续光刺激仅引起短暂的视网膜负电位,而不是常见持续的、平台样变化,并且在第二次光照刺激来临时不能产生有效的反应 [1]。
美国加州大学伯克利分校 Gerald Rubin 实验室的博士后 Craig Montell 随后研究发现,这是由于黑腹果蝇某个类似离子通道膜蛋白的突变而导致的,因此他们率先克隆了该基因,并将该蛋白命名为瞬时受体电位(TRP)通道 [2]。野生型TRP通道介导昆虫视觉细胞中光激活的持续平台电流。同样的通道在脊椎动物中并不存在,但是却有很多在进化上和初始的果蝇TRP通道相关的通道蛋白,形成了一个蛋白超家族。
基于果蝇的TRP是最早被发现的,所有的超家族成员也都以TRP命名并根据蛋白序列的差异分属于TRPC(Canonical)、TRPV(Vanilloid)、TRPM(Melastatin)、TRPA(Ankyrin)、TRPP(Polycystin)、TRPML(Mucolipin)以及TRPN(NOMP-C)七个亚家族(图1)。其中TRPN只在无脊椎动物中发现,初始的果蝇TRP属于TRPC亚家族。
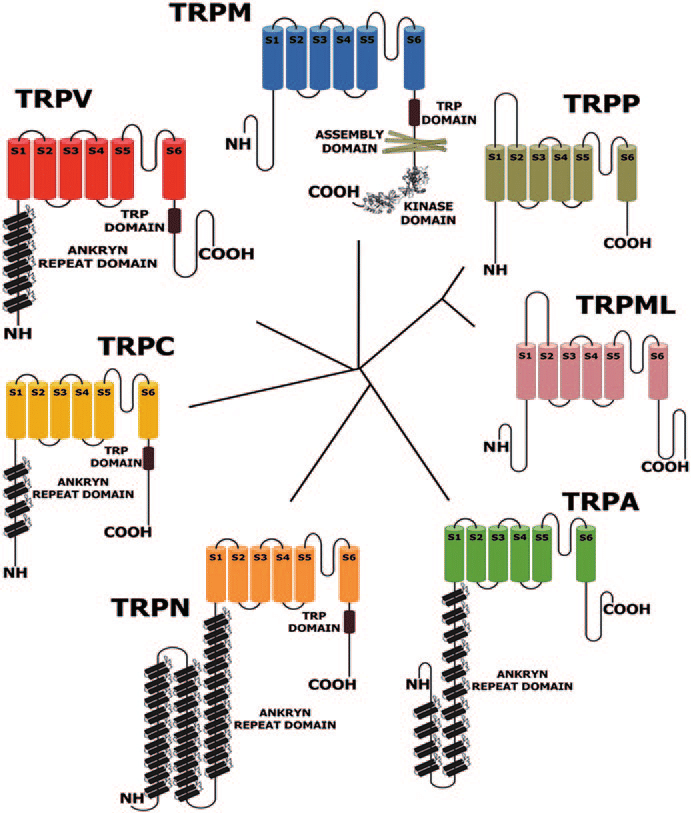
图1 TRP通道亚家族[3]
哺乳动物TRP通道不参与视觉感受,但广泛参与了痛觉的产生与调节,其中以TRPV1为主要代表。长久以来,人们已经知道辣椒浸出液选择性激活背根神经节(Dorsal root ganglion,DRG)的伤害感受神经元,诱导其产生动作电位 [4],将伤害刺激传递给中枢神经系统产生痛觉。但刺激分子辣椒素是通过什么机制激活神经元的呢?
为了筛选与辣椒素结合的受体,1997年加州大学旧金山分校的David Julius教授带领的小组从大鼠DRG中提取了16000多种mRNA,将它们分成不同的组分,分别转入工具细胞中检测其对辣椒素的反应,成功克隆得到了辣椒素受体VR1。对VR1蛋白序列的分析表明VR1属于TRP蛋白超家族,因此被命名为TRPV1通道 [5]。
该基因编码一个6次跨膜蛋白,通道展现出高度的钙离子通透性。TRPV1能被辣椒素特异性激活,同时也能被42℃以上的高温激活,从而不仅确定了辣椒素激活感觉神经元的原理,还首次将痛觉和温度感受联系在一起,揭示了人吃辣椒为什么会同时感到辣和热的分子机制。
迄今为止,已从酵母、昆虫、鱼类及哺乳动物中发现了50余种TRP通道。他们虽然同属于TRP超家族,但序列一致性不超过20%,同时,通道特性也存在巨大的差异,有些TRP通道表达在质膜上,整合细胞内外信息,介导非选择性阳离子内流;有些则分布在细胞器膜上,调节胞内Ca2+的释放 [6]。想要了解通道开放机制和生理功能,解析他们的精细结构势在必行。
2
冷冻电镜关键技术革命引爆结构解析突破
与果蝇trp基因同源性最高,也是全长最早得到解析的哺乳类TRP通道之一是TRPC3。TRPC3在神经系统和心脏中广泛表达,被二酰基甘油(diacylglycerol,DAG)等第二信使激活,感知胞浆钙库耗竭,开放介导非选择性的阳离子电流,参与生长锥导向,突触可塑性,血管收缩等多重生理过程。
2007年Chikara Sato等人合作报道了TRPC3的冷冻电镜结构,这也是第一个被解析出来的全长哺乳类TRP通道结构 [7]。电镜结构显示,TRPC3由四个亚基组成,整个通道形成一个嵌套式的结构,由中间的球形空腔和不连续外壳构成,通道开放时离子通过孔道进入腔体,借由腔体底部四个开口流入胞内。而外壳上分隔出的不同结构域可能也参与了门控机制的精细调节。
紧随其后得到全长解析的是TRPV1通道。2013年,David Julius 教授与和他同一机构的华人科学家程亦凡教授合作,在《自然》杂志连续发表了两篇文章,解析了全长TRPV1关闭态和开放态的结构,此为首个以冷冻电镜方法获得近3Å超高分辨率的膜蛋白结构,大大促进了对TRP通道分子结构的认识,并开创了一个以冷冻电镜为主要手段研究蛋白结构及蛋白与蛋白间相互作用的新时代,也侧面促进了冷冻电镜技术获得2017年诺贝尔化学奖。

图2 加州大学旧金山分校教授程亦凡 | 图源:hhmi.org
通过对TRPV1关闭态结构的分析,研究者发现该通道与电压门控离子通道具有相似的结构:TRPV1为四聚体,每个亚基具有六次跨膜α螺旋结构域,其中第5和第6个跨膜结构域共同构成通道孔区,第1-4个跨膜结构域构成电压感受位点以及辣椒素结合位点 [8]。而在树脂毒碱(辣椒素类似物)和蜘蛛毒素DkTx存在的情况下,可以得到TRPV1的开放态结构,通过对其开放态与关闭态结构的对比,发现TRPV1有独特的双门通道激活机制(图3) [9],虽然其选择性滤器是否构成真正能控制离子流动的上闸门尚有争议 [10]。该工作完美地阐释了辣椒素和质子两种不同配体激活下,TRPV1通道的开放原理与构象变化,但也给我们带来了新的疑问,温度介导TRP通道开放是否也具有特定的结构生物学基础呢?

图3 TRPV1双门通道门控机制 [9]
3
春江水暖 “TRP” 知
除了被配体激活,温度敏感也是TRP家族的一个重要特征。我们把类似TRPV1这种在特定温度下开放的TRP家族成员统称为ThermoTRP。
迄今,在哺乳动物中已鉴定出11种ThermoTRP,包括热受体TRPV1-TRPV4和TRPM2-TRPM5,以及冷受体TRPM8、TRPC5和TRPA1。这些ThermoTRP可以感受整个生理范围内的温度,从产生痛感的灼热,到令人舒适的温暖及凉爽,再到刺骨的寒冷。
此外,ThermoTRP还可以被化学配体所激活,包括刚才提到的辣椒素,还有大蒜素、大麻素、芥末油,薄荷醇和肉桂醛等(图4)[11]。

图4 ThermoTRP及其化学配体
研究人员充分利用各种生物物理学技术和方法,对温度如何激活ThermoTRP通道的机理进行了长期探索。温度代表着区域微观粒子的平均动能,而热传导会影响粒子排布。对于肽链和蛋白质来说,温度改变不仅会影响氨基酸残基的极性强弱,也会大程度改变蛋白质的构象。正是由于这种多模态参与的方式,阻碍了解析ThermoTRP温度激活机制的进程。同时,不同种属温度敏感性的差异,比如,大鼠rTRPV1的激活温度阈值为~42℃,而吸血蝙蝠(Vampire bat)TRPV1的激活温度约30℃,更是增加了鉴定温度传感结构域的挑战性。
对于TRPV1来说,目前鉴定出参与温度门控的区域主要包括N端、C端、外孔区以及孔道区域(图5)。
位于N端的锚定重复域(Ankyrin repeat domain,ARD)决定了十三条纹地松鼠和双峰驼的耐热性,如果把地松鼠来源的sqTRPV1通道第190位天冬氨酸换成类似大鼠的丝氨酸,会介导sqTRPV1热敏感性增加,但不影响其辣椒素和酸诱导的化学激活 [12]。而实验证明,连接ARD和第一个跨膜片段的N端,也被称为细胞膜近端域(Membrane proximal domain,MPD),作为温度感受器而参与介导TRPV1温度敏感性,并决定了温度刺激下的TRPV1通道开关过程中的能量变化和温度感受特性。利用分子生物学手段将这段区域换进rTRPV2,hTRPV2或者mTRPV4等通道,不仅使温度不敏感的亚型转变为温度敏感的通道,也会使野生型通道的温度感受特性变得和TRPV1通道一样 [13]。
此外,受内源性胞内激动剂磷脂酰肌醇(Phosphatidylinositol-4,5-bisphophate,PIP2)影响的通道C端的近膜区与远端,也都是感知温度刺激的重要模块 [14,15]。将热激活的TRPV1与冷激活的TRPM8 C端互换,可以交换其温度敏感性,尤其是将TRPV1 Q727和W752两个氨基酸残基引入野生型TRPM8通道中,可以使其直接表现出热激活的特性,且不与PIP2激活耦联,这说明温度传感与传统配体激活依赖的机制不同 [16]。
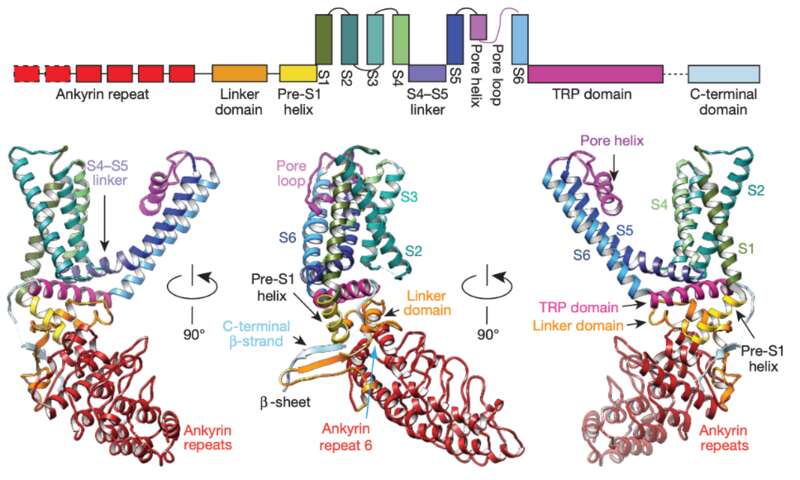
图5 TRPV1温度敏感结构域 [8]
有研究证明,N端和C端两个胞内区也会通过相互作用介导TRPV1的热失活 [17]。除了胞内区,通道孔道及孔道周边也参与了温度敏感性调控,其关键位点,包括位于通道孔区的C617、C622以及位于孔区外的N628、N652、Y653,突变后均会显著影响TRPV1的温度敏感性 [18,19]。每个物种都有最适宜的生存温度,进化压力使得TRP通道表现出了显著的种属差异,这也在侧面论证了TRP家族对于生物适应环境变化具有重要意义。
4
以子之矛,攻子之盾
因为其多种多样的生物学功能以及灵活多变的开放机制,靶向TRP通道进行临床干预具有广泛的应用前景。
以TRPV1为例,它就是非常具有转化价值的镇痛靶点 [20]。作为将伤害刺激转化为电信号的感受器,TRPV1通道在感觉神经末梢过度激活时,也会导致神经病理痛(图6)[21]。例如癌症患者化疗后有时会并发严重的外周神经痛,常规镇痛药不能完全缓解。这可能就是因为顺铂、奥沙利铂和紫杉醇等化疗药促进TRPV1的功能,引起通道表达水平升高、通道敏化及氧化应激反应,诱发机械、热和冷痛敏反应 [22]。靶向TRP通道的药物,可有效缓解癌症患者在化疗时遭受的严重不良反应。例如,树脂毒碱可以作为 “分子手术刀”,通过特异性激活其受体TRPV1通道,引起表达TRPV1的痛觉感受神经元发生钙内流与钙超载,进而导致这些神经元的凋亡,作为慢性癌症疼痛的控制手段 [23]。
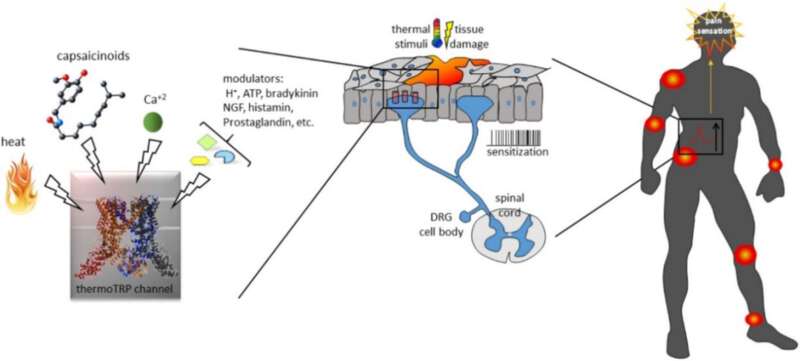
图6 ThermoTRP与疼痛[11]
同时,TRP通道也是治疗呼吸系统疾病的潜在靶点,它们在肺中的免疫细胞和结构细胞中广泛表达,在引起支气管痉挛和咳嗽等呼吸系统症状中发挥核心作用 [24]。吸入辣椒素会激活C纤维引起剧烈的咳嗽反射,而该反射的增强是哮喘、慢性阻塞性肺病、特发性肺纤维化等一系列呼吸道疾病共同的特征之一。靶向呼吸道中高表达的TRPV1、TRPA1、TRPV4、TRPM8等亚基,不仅可以增加肺通气,改善气道阻塞,也可能成为COVID-19等肺部感染治疗中,减轻肺水肿 [25]、改善呼吸窘迫、抑制病毒在宿主细胞间传递 [26] 的辅助干预策略。
除此之外,靶向TRP家族,尤其是TRPM亚家族干预神经系统疾病也具有临床转化意义。TRPM2抑制剂JNJ-28583113可以显著缓解小鼠缺血性中风过程中神经元的氧化应激损伤 [27],而TRPM4亚基不仅通过促进N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)膜转运,加重突触周NMDAR介导的神经元死亡 [28],还可以与磺酰脲受体1(Sulfonylurea-receptor 1,SUR1)形成复合体,增加血脑屏障通透性 [29],与水通道蛋白4(Aquaporin 4,AQP4)形成聚合体加剧中风时星形胶质细胞的肿胀,导致更严重的神经损伤 [30]。外源格列苯脲靶向SUR1-TRPM4异聚体干预缺血性中风已经进入临床三期阶段。这进一步说明了靶向TRP通道干预中枢神经系统疾病的应用前景。
TRP通道的研究还在继续,这不仅是我们理解机体如何感知外界刺激(温度、压力、伤害刺激)的分子窗口,也是极具启发性和延续性的靶标探索史诗,其从结构到功能的研究范式对后续膜蛋白的研究产生了深远的影响。临床医学的进步与革新离不开基础科学的探索与发现,希望随着我们对TRP通道和其他膜蛋白了解的深入,能真正揭开生物进化的奥秘,产生更多有启发性和临床转化价值的研究成果。