来源:我是科学家iScientist
不久前,《自然》杂志刚刚公布了2018年科技领域的十大影响力人物。其中,制造了世界首例基因编辑婴儿的贺建奎教授以“CRISPR独走者”(CRISPR Rogue)的名号赫然上榜。在这一事件中,科学界的态度是一致的:CRISPR技术不应用在健康婴儿的基因改造上,我们绝不能支持这样缺乏监管、有违科研伦理的临床试验。

贺建奎以“CRISPR独走者”(CRISPR Rogue)的名号登上《自然》杂志2018年科技领域的十大影响力人物。图片来源:Nature
然而随之而来的社会讨论中有许多值得商榷的观点,其中之一是:基因编辑技术就是一种转基因技术,因此转基因食品的生产和基因编辑婴儿的制造都一样,是“坏”的技术应用。
这个类比有明显的逻辑错误,毫无道理。简单来说,基因编辑技术确实可以用来进行转基因操作,但是操作对象是决定试验伦理的关键所在——在动植物中可以反复试错和修改的操作,在人体试验中必须符合高得多的安全标准。
因此,我们应该反对贺建奎这种有悖伦理和存在风险的基因编辑婴儿试验,但是不必以此为出发点质疑已有大量研究基础的正规转基因产品的安全性。
CRISPR:能瞄准的瑞士军刀
其实,基因编辑与其说是一种技术,不如说是一个目标。生物体的基因组中包含着成千上万个指导各种生命过程的基因,从上世纪90年代的人类基因组计划开始,生物学领域的一大梦想就是能读懂基因组的运作方式。而了解的最终目的之一,就是改造——对基因组的特定修改,也就是基因编辑,在动植物中可以改变性状,为我们所用;而在人体自身,则是治疗疾病的希望。
这次被用于临床试验的CRISPR-Cas9技术,正是时下应用广泛的一种实现基因编辑的手段。CRISPR的全称是“规律间隔成簇短回文重复序列”,这些DNA片段相当于“入侵者”噬菌体在细菌自己资料库里的“备案”,当有过备案的噬菌体再次进入细菌体内时,从这个CRISPR资料库里按照备案打印出的“通缉照”——向导RNA,就能引导着带有DNA剪切功能的Cas9蛋白,把噬菌体的基因组切断,将“入侵行动”消灭在萌芽中。
根据这个原理,我们只要把CRISPR资料库中针对噬菌体的“备案”换成其他物种的DNA序列,不就能“指哪打哪”了吗?相较于之前的基因编辑技术而言,利用CRISPR对DNA进行“打靶”实在是好用太多了:它成本低廉,设计简单,又快又准,而且可以一次剪切多个位点(同时引入多条“引导RNA”)。自从2012-2013年在微生物和模式动物中成功实现后,CRISPR已经成为了很多生物实验室的日常标配。
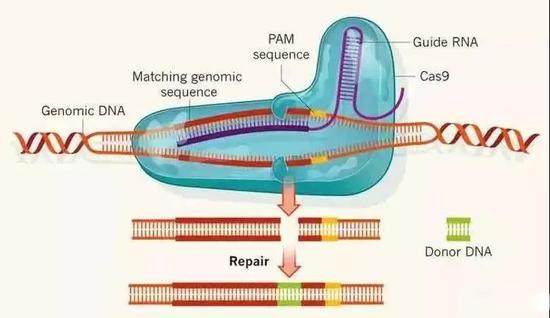
CRISPR/Cas9的基因编辑原理
虽然在细菌体内只是一种防御武器,但在分子生物学家的手中,CRISPR变成了一把带瞄准系统的多功能“瑞士军刀”:比如在剪切目标位点的同时引入一段供体DNA序列,可以实现把这段序列插入目标位点——这其实就是转基因。所以说,CRISPR-Cas9系统能够实现基因编辑的目的,其中一个应用就是转基因。

CRISPR就像一把带瞄准系统的多功能“瑞士军刀”。图片来源:Pixabay
转基因操作是指使用载体将外源基因整合入生物体自身的基因组,从而在转基因生物体内表达特定的蛋白产物,比如在玉米中表达抗虫的Bt蛋白。注意,这里只说了“整合入”,并没说要整合到基因组上的哪个位置。相比较于传统的转基因操作来说,CRISPR其实是更加优秀的——可以更精准地把基因转入基因组上的特定位置。
除了转入外源基因,CRISPR还可用于基因敲除,它在农业中也用处多多,比如中国研制成功的低镉水稻,就是用CRISPR“剪掉”了水稻基因组中负责吸收镉元素的基因,哪怕在镉污染地区也能种出不吸收镉、含镉量低于安全值的大米。

水稻容易蓄积镉,用CRISPR“剪掉”了水稻基因组中负责吸收镉元素的基因,可以种出不吸收镉、含镉量低于安全值的大米。图片来源:Pixabay
虽然如此优秀,CRISPR却也并非百分之百地精准:“脱靶”效应在CRISPR应用中一直是研究者关心的问题。在剪切、修饰目标位点的同时,“向导RNA”在基因组中其它区域的不精确匹配也会导致一些“计划外”的修饰,对其它基因组区域进行了剪切、插入等等反应。目前,提高CRISPR系统的修饰精准性,减少“脱靶”,是基因编辑领域的一大热门。
转基因研发:用实验事实说话的安全性
CRISPR的“脱靶”和传统转基因操作的随机插入一样,有可能会破坏基因组中一些不该被破坏的基因。因此,要得到一个符合我们生产生活需求的转基因物种,“转基因操作”只是第一步。把基因“送进去”之后,研究者需要通过各种检测来确认很多事情:基因是否成功整合进了基因组?整合到了基因组的什么地方?整合后的基因,有没有活性,能不能指导合成我们想要的产物?这个外源基因的产物,结构是否正确,功能是否正常?转基因后的粮食/禽畜,吃了有没有问题?等等……
在操作对象是粮食作物、家禽家畜时,这并不是什么大问题——我们有源源不断的实验对象用来进行各种测试:分析基因产物,与天然作物/产品进行对比,喂食实验动物观察不良反应等等。一次转基因操作不成功,我们还可以放弃失败的测试对象重头再来,直到制造出符合我们期望的转基因物种——更有营养、抗性更好、有害物质含量更少、产量更高、更好吃/好用、不会污染环境/影响生态等等。无论是在转基因技术的发源地美国,还是在我国、欧洲等地区,各种转基因物种和产品都要经历严格的审查过程,用科学的实验设计来验证产品对人体没有危害。
喂食实验动物观察转基因食品是否具有不良反应。图片来源:图虫创意
事实上,基因编辑和转基因操作本质上是对基因组进行了修改,生物学上属于基因组中的变异;而无论是自然的演化过程还是传统的杂交育种、人工选育,也都是试图保留基因组中产生的、导致优良性状的变异。有了完善的监管体系,无论是转基因物种还是基因编辑作物,都不会比传统杂交作物的危险性更大,理性接受是完全没问题的。
人体基因编辑:星辰大海的路,得一步一步走
那么,基因编辑婴儿的问题在哪儿呢?相信你已经想到了——很简单,人不能随便拿来做实验。一种新开发出的药物,在被证明对人体足够安全之前,是不能随便给人(尤其是健康人)吃的。目的是治疗或者预防疾病的基因编辑也是一样:在人体中进行基因操作之前,我们必须用其它的实验手段改进技术,充分证明我们能以最大的把握避免副作用,获得成功。这里的对比非常显而易见:研发转基因动植物时,一次差错意味着科研人员需要进行下一次尝试;而用基因编辑治病时,一次差错就是对一个人类个体的生命威胁,当然应该慎之又慎。

用基因编辑治病时,一次差错就是对一个人类个体的生命威胁,当然应该慎之又慎。图片来源:Pixabay
反观这次基因编辑试验,很多方面违反了这种科研和医学伦理精神:这个试验设计的伦理审查显然并不完善,没有业内专家参与审核;对于被编辑婴儿的监护人,也就是应该签署知情同意书的父母,他们是否得到了足够客观的背景介绍也不得而知;试验的目标并没有选择其他方法难以治愈的疑难杂症,而是本可以通过各种成熟手段预防的HIV传染;最重要的是,前面说到的脱靶等技术风险问题还没有得到足够的改善,两个原本能够健康降生的婴儿没必要也不应该承担这些风险。
事实上,基因编辑目前并不是没有在人体中的成功应用。例如2017年经由美国食品及药品监督管理局(FDA)审批的CAR-T疗法,通过在体外编辑患者自己的免疫T细胞,往基因组里转入了特定的基因,让这些细胞能够表达识别癌细胞的“抗原受体”蛋白质,同时在识别出癌细胞后能激发免疫反应,对癌细胞“定点清除”。
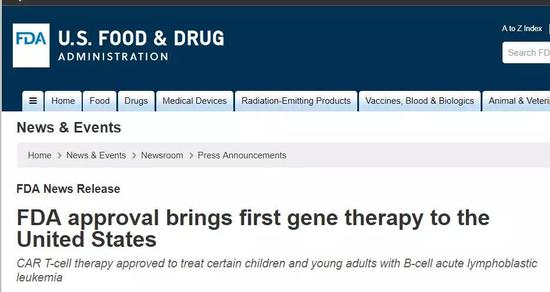
2017年美国食品及药品监督管理局(FDA)审批通过了CAR-T疗法。图片来源:fda.gov。
这样的基因编辑操作建立在以治疗别无他法的重大疾病为目的,得到患者的知情,并在专门的医疗机构由专业人员实施的基础上,编辑操作只涉及患者体细胞,不会把改造过的基因遗传给后代。这样规范的基因编辑操作有望挽救成千上万绝症患者的生命,也是利用基因编辑治病救人的成功一步。可以看出,我们不能因噎废食——优秀的技术,需要合理的利用来实现其价值。

优秀的技术,需要合理的利用来实现其价值。图片来源:图虫创意
无论是基因编辑还是转基因,使用这些技术为人类制造吃穿用度也好,为人类治病也好,最起码的底线都是不能增加对任何人生命健康权的危害。合理监管和经过严格测试的转基因产品达到了这个标准,而这一次的基因编辑婴儿试验,无论从结果来看还是从试验过程来看,都没有能够保证“不危害健康”这个底线,在合理的监管体系下绝不该发生。
现在,我们只能寄希望于被编辑的两个女婴并无健康问题,过上正常的生活;对人体基因编辑,需要加以合理而严格的监管;而面对层层把关的转基因农副产品,则完全可以以科学理性的态度接受。


