5磅9盎司,19英寸。1984年的10月14日,女婴史蒂芬妮·菲伊·波克莱(Stephanie Fae Beauclair)降生了。 喜悦的氛围还未来得及在家庭中弥漫,医生便带来一个噩耗:“超声结果显示您的孩子患有左心发育不全综合征(hypoplastric left heart syndrome)。”这是一种先天性心脏畸形,患儿可能在出生后数小时到数日内死于急性左心衰竭。

小史蒂芬妮和母亲特蕾莎
史蒂芬妮很快被从老家巴斯托(Barstow)转院到洛马琳达大学(Loma Linda University)医学院。但在当时,尝试修复这种缺陷的手术往往只是徒劳,几乎没有任何可以将婴儿寿命延长至一个月以上的案例。
类似的婴幼儿心脏移植手术也从未成功过(实际上,能在屈指可数的心脏捐献者中找到配型就已经难如登天了)。
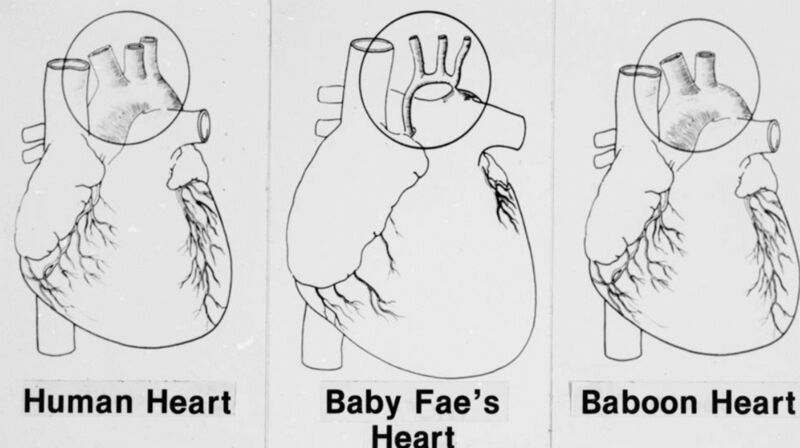
正常人类心脏,史蒂芬妮的心脏,狒狒的心脏对比图 史蒂芬妮的母亲沉浸在极度的悲痛之中,但还是逐渐接受了现实。 在史蒂芬妮被母亲带回家中等待死亡时,电话突然响起。是洛马琳达大学的伦纳德·贝利医生(Dr Leonard L. Bailey)的助手打来的,他告诉这位母亲,小史蒂芬妮或许有救。计划就是:将小狒狒的心脏移植给史蒂芬妮。

医生的赌局
由于一时无法接受这种疯狂的想法,母亲的惊喜立刻转变成了怀疑。实际上,贝利医生本人最清楚这样做的风险。但在这场与死神的赌局之中,他也握有自己的筹码。
70年代,作为一名胸外科和心血管外科医生,贝利医生见证了太多死于左心发育不全综合征的新生儿。贝利为此感到难过和困扰,因为他只能眼睁睁看着婴儿死去。他认为,这些不幸的孩子需要的只是一颗新的心脏。 1976年,贝利医生回到母校洛马琳达大学,在医学院任副教授。之后几年里,他在动物幼崽身上进行了200多次移植实验,以评估在哺乳动物上进行器官移植的可行性。

贝利医生,1969年在洛玛林达大学医学院获得医学博士学位
因此,史蒂芬妮对贝利医生来说是极好的研究案例。更重要的是,史蒂芬妮可能因此重获新生。
贝利医生连夜向史蒂芬妮的家人介绍自己的研究和手术方案。在了解了手术风险后,史蒂芬妮的家人将孩子交给了贝利医生和他的专家团队。 由于本次手术极具先驱性,且牵涉到伦理问题,可想而知,这将引起全社会的关注和热议。为了保护孩子和家庭的隐私,史蒂芬妮有了一个可爱的新名字:菲宝(Baby Fae)

惊喜,遗憾与心愿
经过筛查,贝利医生选中了六只大小合适的狒狒作为心脏供体,并立刻对只有六天大的菲宝进行了免疫学检测。这些幼年雌性狒狒也通过了重重检查,包括胸透、肝脏检查、结核菌素检测、心电图、HLA(人类白细胞抗原)检测等。
贝利医生和其他医护人员在手术室中奋战
手术在10月26日进行。贝利医生和同事们在手术无影灯下奋战:原位移植,重建主动脉弓……他们小心翼翼地进行了一项又一项操作,完成所有预定手术步骤后,所有人紧张地盯着等待婴儿的反应。 很快,医生和家人收获了一个惊喜:术后不久,这颗狒狒心脏在菲宝的体内开始正常工作!
手术成功后安然入睡的“菲宝”
第二天,这场手术便成为了各大新闻媒体的头版头条。各地记者蜂拥到洛马琳达,这座不大的小城医院瞬间热闹非凡:记者们捕捉每一个画面,有人为小婴儿欢呼,有人质疑贝利,有人追问医院方面以及菲宝父母的动机,有人讨论这个历史性手术的伦理问题。当然,也有动物权利人士高举标语,抗议贝利医生的所作所为…… 之后的住院期间,菲宝没有发生局部感染,伤口愈合良好。医生们每天都对菲宝进行细胞化学、超声心动图和免疫学监测。各项指标均正常。

手术后的菲宝恢复良好,部分医护人员为“奇迹”而感动落泪 然而,惊喜并没有维持很久:11月6日,菲宝食欲减退,并出现轻度呼吸急促。9日,菲宝明确出现了心脏功能损伤。12日,菲宝出现了明显的心肌损伤,并表现出移植排斥反应。15日晚7时,菲宝发生完全性心脏传导阻滞。
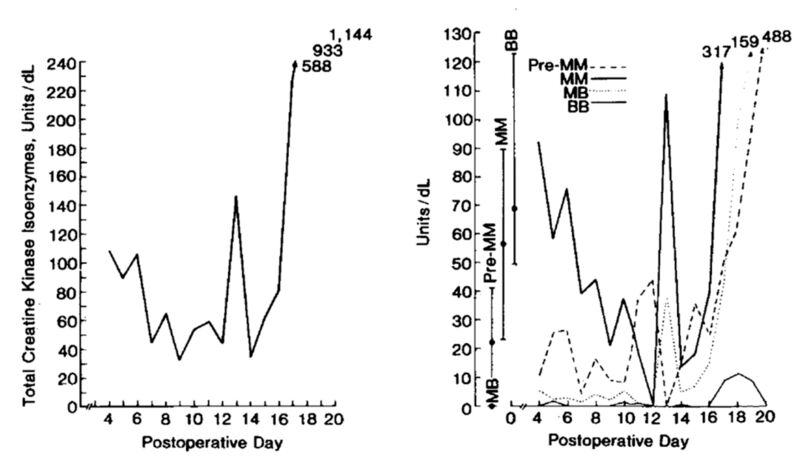
菲宝术后每日的肌酸激酶同工酶水平。左图为总水平,右图为各种成分水平。第16日之后的骤变表示菲宝出现了心肌损伤。
1984年11月15日晚9时,菲宝的生命又一次走到了终点。 次日,贝利医生出席新闻发布会。他强忍着泪水发布了这一令人遗憾的消息。面
对媒体和社会的怀疑甚至口诛笔伐,辩解或道歉都是苍白的。

菲宝的经历很快成为媒体关注和社会讨论的热点
贝利医生却掷地有声地对记者说:“由于这名婴儿和她父母的勇气,在不久的将来,患有心脏病的婴儿将免于夭折。”

异种移植,还有多远?
贝利医生所说的并非一句空话。 尽管结果令人惋惜,但菲宝的案例和研究为贝利和他的团队提供了大量宝贵经验。一年后,他们完成了世界首例人对人的儿童心脏移植。洛马琳达大学健康中心在贝利医生等人的努力下,也逐渐成为了全球首屈一指的婴幼儿心脏移植中心,并在治疗方面取得了进步,为罹患心脏病的婴儿提供了移植之外的解决方案。
洛马琳达大学医学中心,如今在美国享有盛誉的医院之一
事实上,在手术后一周,器官捐赠中心都在为菲宝寻找配型的人类心脏,然而最终无果。这也是令人遗憾的一点。
尽管人们捐赠器官的意识越来越强,供体器官仍然供不应求。移植器官短缺的难题也促使科学家们不断探索异种移植的可能性。
异种移植,就是指将不同种类动物器官(组织或细胞)进行移植,是解决人类器官配型短缺最有前景的方法。但目前,异种移植的临床应用仍然困难重重。其中,最大的困难便是排斥反应:自体免疫系统攻击和排斥外来的器官。

曾被人类作为候选供体的动物们
相较于同种异体移植,异种异体移植的排斥反应更剧烈,个中机制也更复杂。临床常用的免疫抑制手段很难令人满意,还容易引起患者出现免疫力极度低下和病原体感染等严重并发症。 异种移植研究一度陷入了低谷和僵局。不过近年来,基因编辑和免疫学技术的进步推动了异种移植的快速发展,越来越多的学者开始从事该领域研究。 就心脏移植来说,每年有无数终末期心脏病患者在等待供体的过程中死亡。相比机械辅助和再生医学方案,活体器官移植有着难以替代的优势。因此异种心脏移植(Cardiac xenotransplantation, CXTx)成为了目前医生们关注的热点。 供体也从羊,狒狒,黑猩猩再到小型猪,呈现波浪式发展。由于猪心脏的结构与生理和人类心脏相似,且通过基因修饰可以有效降低猪供心脏的免疫原性,所以猪 CXTx 是目前研究热点。
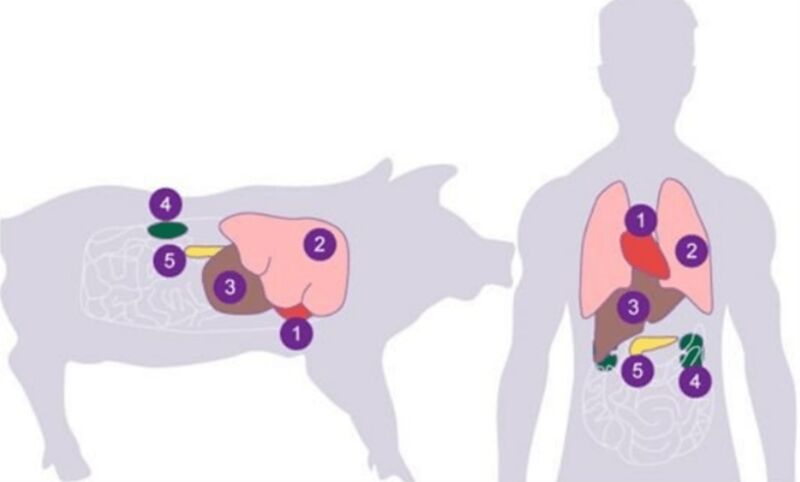
猪与人类器官分布对比图
为了克服免疫排斥反应,科学家们尝试了从基因入手:从最早期的单基因敲除,到近年来的多基因修饰策略。目前CXTx最常用的α -1,3- 半乳糖基转移酶(α -1,3-galactosyltransferase, GGTA1)基因敲除技术已经能使猪移植术后的免疫排斥反应大大降低。
与心脏保护相关的靶基因很多,随着基因编辑技术(如CRISPR/Cas9)的迅猛发展,尝试将更多基因整合在一起,构建出免疫原性更小的器官是目前的热点。研究人员相信,在转基因猪中加入更多的人类基因,有可能延长供心存活时间,最终实现 CXTx 临床应用。

贺建奎和当年震惊社会的“基因编辑婴儿”便是依赖于CRISPR/Cas9技术
基因修饰策略显著降低了移植术后早期的超急性排斥反应。同时,为了保证受体能够长期存活,研究人员还针对免疫抑制进行了大量研究。新型免疫抑制剂在调节排斥反应中的应用也是异种移植研究的重要方面。
然而,尽管有上述研究进展,猪CXTx仍然面临许多棘手难题。一个主要风险便是猪心脏携带的病原体。尽管利用育种技术可以避免外源性病毒污染,但猪内源性反转录病毒( porcine endogenous retroviruses, PERVs)能够在人基因组中整合,因此不能用传统的抗病毒方法消除。 2017年,哈佛女科学家杨璐菡领导的研究团队在《Science》上发文:研究团队利用基因编辑技术,清除了猪基因组中的PERVs基因。这项成果是扫清猪器官用于人体移植障碍的一大突破,成为当年的科研新闻热点,足见学界和社会对器官移植的重视。

因创造出PERVs基因失活的幼猪而广受关注的哈佛女科学家杨璐菡
除了医学方面的难题,异种移植更是始终承受着伦理方面的争议。因此,患者心理因素、法律、宗教信仰等复杂因素将如何协调,也是异种移植需要考虑的问题。如果这些问题都得以解决,可以想见,无数患者将从绝望中解脱。
2019年5月12日,贝利医生因癌症去世,享年76岁。在洛马琳达大学的42年里,贝利医生进行了无数次婴幼儿开胸手术,这些康复的孩子都拥有了健康的人生,有些甚至成为了贝利医生的同行。但这些成就都无法完全抚平贝利医生心中关于菲宝的遗憾。

生命的最后几年依然坚持工作的贝利医生
或许将来某一天,异种器官移植将不再困难重重,为人类健康带来福祉。
但是,当动物器官成为人类体内的常客,“人与兽”之间的界限是否会变得模糊呢?人的“精神”能真正主宰“兽体”吗?又或者,你能接受对方拥有一颗野兽的心脏或大脑吗?


