科技部生物中心主任张新民回答记者提问。
新京报讯 3月17日,国务院联防联控机制召开发布会,介绍药物疫苗和检测试剂研发攻关最新情况。会上,科技部生物中心主任张新民介绍,法匹拉韦已完成临床研究,显示出很好的临床疗效。
在安全性方面,法匹拉韦已经于2014年在日本获批上市,上市以来未见明显的不良反应。在治疗新冠肺炎的临床研究中,未发现明显的不良反应。
在有效性方面,深圳市第三人民医院开展的法匹拉韦联合干扰素治疗新冠肺炎有效性和安全性研究,入组患者80例,其中法匹拉韦组35例,对照组45例。研究结果显示,在病毒核酸转阴方面,法匹拉韦治疗组治疗后患者病毒核酸转阴与对照组相比,转阴时间中位值明显缩短,分别为4天和11天,具有显著差异。在胸部影像学改善方面,与对照组相比,改善率分别为91.43%和62.22%。
武汉大学中南医院牵头开展了法匹拉韦治疗新冠肺炎的多中心、随机、开放、阳性平行对照临床研究,已完成各120例入组和临床治疗观察。临床研究结果显示,试验组治疗新冠肺炎的疗效显著优于对照组。在主要终点评价指标方面,普通型患者在治疗结束时的临床恢复率,试验组显著优于对照组,分别为71.43%和55.86%。在次要终点评价指标方面,试验组在退热时间上显著优于对照组,平均退热时间分别为2.5天和4.2天。试验组在咳嗽缓解时间上显著优于对照组,平均咳嗽缓解时间分别为4.57天和5.98天,普通型患者在治疗期间的辅助氧疗或无创机械通气率,试验组显著低于对照组,分别为8.16%和17.12%。以上评价指标,两组间均具有统计学的差异。
在可及性方面,今年2月国内已有企业获得国家药监局药品注册批件,并实现量产,临床药品供应有保障。

国务院联防联控机制召开发布会,介绍药物疫苗和检测试剂研发攻关最新情况。

教育部科技司司长雷
朝滋回答记者提问。

国家中医药管理局科技司司长李昱回答记者提问。

中国工程院院士王军志回答记者提问。

中国医学科学院实验动物研究所研究员秦川回答记者提问。
法匹拉韦治疗新冠肺炎4天见效 海正药业已获生产批件
国务院联防联控机制3月17日举行发布会,生物中心主任张新民介绍,法匹拉韦(法维拉韦)已完成临床研究,显示出良好临床疗效,未出现明显不良反应。
海正药业(12.950, -0.54, -4.00%)(600267)2月16日晚间公告了法匹拉韦获批的消息。2016年,海正药业获得了法匹拉韦在华的独家专利授权。获得专利的浙江海正药业,有权对法匹拉韦进行仿制药品的研发、生产、销售。
目前海正药业是唯一获批的一家。
这是疫情期间全国第一个获批上市的治疗新冠肺炎的药物。
法匹拉韦安全性好、疗效明确
有媒体报道,海正药业在2月15日通过审批后,16日凌晨就组织人员投料生产,确保以最快的速度投放市场,第一批预计产出十万片。随着产能不断扩大,法匹拉韦未来月产能或将达到一千万片。
目前,还有四环制药、廊坊高博京邦制药、瑞阳制药有限公司、石药集团、中国人民解放军军事医学科学院毒物药物研究所的相关法匹拉韦产品已经提交审批。
年后,海正药业受益于疫情概念,股价上涨近8成,不过近日股价下调,今日下跌4%。
海正药业今日晚间公告,合计持股9.17%的股东国贸集团及其一致行动人英特药业,拟通过集中竞价交易方式合计减持不超过公司总股本2%的股份。
在今日发布会上,张新民称,深圳市第三人民医院开展的法匹拉韦联合干扰素治疗新冠肺炎有效性和安全性研究结果显示,在病毒核酸转阴方面,法匹拉韦治疗组治疗后患者病毒核酸转阴与对照组相比,转阴时间中位值明显缩短,分别为4天和11天,具有显著差异。在胸部影像学改善方面,与对照组相比,改善率分别为91.43%和62.22%。在治疗新冠肺炎的临床研究中,法匹拉韦未发现明显的不良反应。
简而言之,也就说用了法匹拉韦4天就见效,而且改善率超过9成,可以说此药效果绝佳。
此前,3月6日,张新民表示就表态,法匹拉韦(法维拉韦)的安全性好、疗效明确。
武汉大学中南医院牵头一项针对多中心临床研究也证实,法匹拉韦组第3天体温复常率为81.8%,对照组只有29.5%;第6天咳嗽缓解率达93.2%,对照组为 68.2%。
除了在新冠肺炎治疗上显示出不错的效果外,法匹拉韦还对多种RNA 病毒展现出良好的抗病毒作用,如埃博拉病毒、沙粒病毒、布尼亚病毒、狂犬病毒等。
日本研发
法匹拉韦是由日本富士公司研发的广谱抗病毒药物。早在2008年,转型期的富士胶片看中了正处于研究阶段的Avigan(法匹拉韦)针对流感有效性的表现,收购了富山化学,成为该药专利的实际拥有者。
2014年Avigan在日本上市用于治疗新型和复发型流感,并在对抗埃博拉病毒上名声大噪。
2016年浙江海正药业与日本富山化学工业株式会社签订了化合物专利独家授权协议,负责在中国研发、制造、销售含法匹拉韦的抗流感病毒药物,本次获批的法维拉韦片为Avigan在国内的首仿药品。
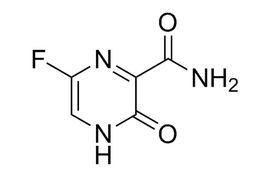
法匹拉韦结构式
2014年3月,法匹拉韦获批在日本上市,适应症为用于治疗成人新型或再次流行的流感(仅限于其它抗流感病毒药物治疗无效或效果不佳时使用)。富山化学工业株式会社于1999年8月对法匹拉韦进行了最早的化合物专利申请,期限20年,该化合物专利已于2019年8月到期。除了化合物专利外,原研公司于2008年-2016年期间还申请了中间体、组合物、制备方法、制剂、药品衍生物等外围专利,形成了较为完善的专利。
法匹拉韦在中国的表现也让日本方面重视起来,日本厚生劳动大臣加藤胜信在2月22日表示,目前还没有针对新冠肺炎患者的既定治疗方案,不过日本正在考虑使用抗流感药物法匹拉韦(Avigan)治疗新冠肺炎患者。富士胶片发言人高口弘随后表示,在日本政府要求下,富士胶片正在考虑提高该药品产量。
在没有可靠新药的情况下,国内的办法是筛选有希望的成熟药品,迅速投入到试验中。2月15日,国务院联防联控机制召开新闻发布会,提到三种药物,其中之一就是法匹拉韦。这些药品是从70000个药品核心化合物通过模拟筛选和多轮的体外实验筛选出来的,并将先后开展临床试验。不过没有提到此前备受期待的美国药品remdesivir,由全球最大的生物制药公司——美国吉利德科学公司所研发。
这些药物是针对轻型、普通型向重型转化的阻断,新冠肺炎本身就有比较高的自愈率。而针对重型、危重型患者的救治,重点推动恢复期血浆、托珠单抗、干细胞和人工肝的临床应用。
获科技部推荐,海正药业国内首批上市,法匹拉韦是什么药
新京报讯(记者李云琦)3月17日,在国务院联防联控机制3月17日举行的新闻发布会上,科技部生物中心主任张新民介绍,法匹拉韦已实现量产,临床供应有保障。经专家论证,已建议尽快纳入诊疗方案。
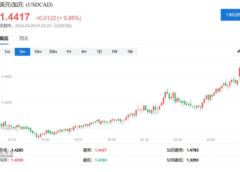
根据国家药监局显示,目前的法匹拉韦产品仅有浙江海正药业股份有限公司拥有生产批号,批准日期显示为2020年2月15日。在3月初,港股上市公司四环医药也宣布,启动法匹拉韦片用于新型冠状病毒疫病的临床研究。
为广谱抗病毒药物 试验证明对新冠肺炎临床疗效良好
资料显示,法匹拉韦是由日本富士公司研发的广谱抗病毒药物,该药物对丝状病毒科、布尼亚病毒科、沙粒病毒科、披膜病毒科等烈性 RNA 病毒科成员以及正黏病毒科、副黏病毒科、小 RNA 病毒科、黄病毒科等非烈性 RNA 病毒科成员在体外及体内均具有良好的抑制效果。临床试验结果显示,法匹拉韦能够有效缩短流感病程时间,降低病毒载量。
2014年3月,法匹拉韦获批在日本上市,适应症为用于治疗成人新型或再次流行的流感(仅限于其它抗流感病毒药物治疗无效或效果不佳时使用)。富山化学工业株式会社于1999年8月对法匹拉韦进行了最早的化合物专利申请,期限20年,该化合物专利已于2019年8月到期。
根据港股上市公司四环医药公告,2020年2月15日,国务院联防联控机制召开新闻发布会,特别提到三种药物,其中之一就是法匹拉韦。此次新闻发布会介绍少数聚焦的几个药品是在经过三轮的研发筛选,从70000个药品核心化合物通过模拟筛选和多轮的体外实验筛选出来的,并将先后开展临床试验。
四环医药称,法匹拉韦为广谱核糖核酸(「RNA」)聚合酶抑制剂,该药口服吸收后转化为具有生物活性的法匹拉韦的核苷三磷酸化物,结构与嘌呤相似,能与嘌呤竞争病毒抑制RNA聚合酶,从而抑制病毒复制。另外,研究发现法匹拉韦的核苷三磷酸化物还可插入到病毒RNA链,诱发病毒的致命性突变。从机制上,法匹拉韦对各种RNA病毒都具有潜在的抗病毒作用。
3月17日,科技部生物中心主任张新民表示,法匹拉韦已经在深圳市第三人民医院开展的法匹拉韦联合干扰素治疗新冠肺炎有效性和安全性研究,入组患者80例,其中法匹拉韦组35例,对照组45例。
其表示,研究结果显示,在病毒核酸转阴方面,法匹拉韦治疗组治疗后患者病毒核酸转阴与对照组相比,转阴时间中位值明显缩短,分别为4天和11天,具有显著差异。在胸部影像学改善方面,与对照组相比,改善率分别为91.43%和62.22%。
张新民还提到,武汉大学中南医院牵头开展了法匹拉韦治疗新冠肺炎的多中心、随机、开放、阳性平行对照临床研究,已完成各120例入组和临床治疗观察。临床研究结果显示,试验组治疗新冠肺炎的疗效显著优于对照组。
国内仅海正药业取得法匹拉韦生产批件 四环医药宣布启动临床研究
目前,法匹拉韦在国内已经有海正药业取得生产批件。
3月17日,新京报记者在国家药监局官网查询看到,目前国内仅有浙江海正药业股份有限公司拥有生产批号,批准日期显示为2020年2月15日。该产品剂型为片剂,适应症为用于治疗成人新型或再次流行的流感(仅限于其它抗流感病毒药物治疗无效或效果不佳时使用)。
针对法匹拉韦的生产情况,科技部生物中心主任张新民3月17日公开表示,今年2月国内已有企业获得国家药监局药品注册批件,并实现量产,临床药品供应有保障。
根据海正药业2月17日发布的公告,公司收到国家药监局核准签发的法匹拉韦片的《药品注册批件》外,还拿到了《药物临床试验批件》。
该药物的《药物临床试验批件》批件显示的审批结论为,根据《药品管理法》、《药品注册管理办法》和《药品特别审批程序》,经特别专家组评议审核,应急批准本品进行临床试验。适应症为新型冠状病毒肺炎。
海正药业称,经查询IMS数据库,未查询到该品种在国内外市场的销量数据。截至目前,公司在法维拉韦研发项目上已投入约4003万元。
当时海正药业表示,本次获得的《药物临床试验批件》针对新适应症,目前临床试验尚待开展,后续待完成一系列临床试验步骤后还需提交审评审批,临床试验结果存在不确定性,能否取得新适应症的生产注册存在不确定性。海正药业提示,此前公司该药品未实现商业化生产,本次获批事项对公司当期业绩影响较小。
值得注意的是,除海正药业外,四环医药此前也宣布启动法匹拉韦片用于2019冠状病毒病的临床研究。
四环医药3月2日宣布,由中国人民解放军军事科学院军事医学研究院微生物流行病研究所与四环医药共同研制开发的法匹拉韦片用于2019冠状病毒病的临床研究已于近日启动。该研究2月初被国家科技部正式立项。中国人类遗传资源管理办公室紧急审评该研究 ,目前该研究正在顺利进行当中。
四环医药表示,该研究组长单位为首都医科大学附属北京朝阳医院,另外两家研究中心包括华中科技大学同济医学院附属协和医院及武汉市金银潭医院。该研究计划入组60例普通型COVID-19患者,治疗期为10天。
“本集团经过多方努力和筹备,已经做好法匹拉韦原料及制剂生产的充分准备。法匹拉韦片一旦获批上市,将可以为疫情期间的COVID-19患者提供免费药品保障”。
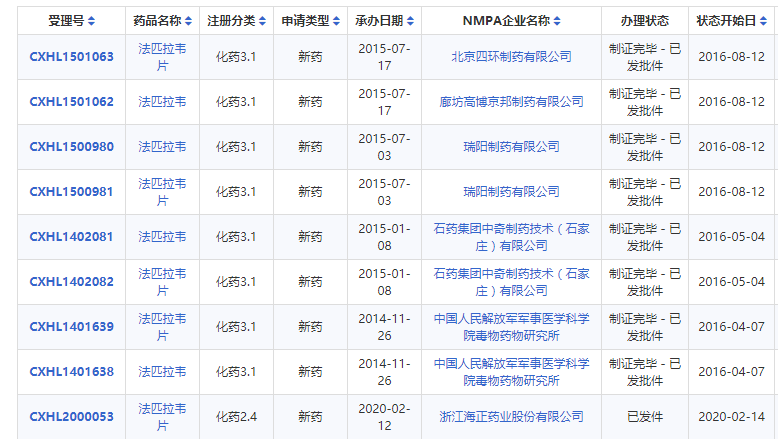
药智数据平台显示,目前还有司机四环制药、廊坊高博京邦制药、瑞阳制药有限公司、石药集团、中国人民解放军军事医学科学院毒物药物研究所的相关法匹拉韦产品已经提交审批。