美国食品及药物管理局(Food and Drug Administration – FDA)对所生产药物中含致癌物质成分的中国工厂进行了检查,在最近几个月里,有数十种这些海外工厂生产的降压药被召回。
FDA对所生产药物中含致癌物质成分的中国大陆浙江华海制药工厂进行了检查(图源:FDA)
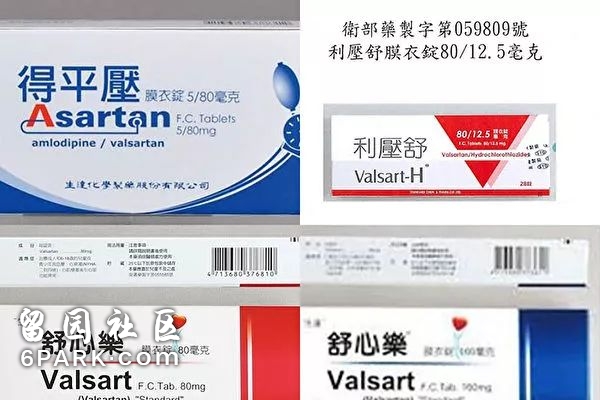
据“今日美国”网站报导,制药公司召回了数十种诸如缬沙坦(valsartan)、氯沙坦(losartan )和厄贝沙坦(irbesartan )——单独使用或与其它药物一起使用的药物等一线高血压和心脏病药物,试验发现这些药物中含有微量的致癌物质。
美国食品和药物管理局正在调查这些药品中含有致癌物质的根本原因。目前该联邦机构尚未完成调查,但检验报告显示,在致癌物质被发现之前,两家工厂——中国浙江华海制药有限公司(Zhejiang Huahai Pharmaceutical)和印度Hetero Labs制药有限公司——就一直存在问题。
这些被召回的药品是一大类被称为血管紧张素II受体拮抗剂(Angiotensin II receptor blockers – ARBs)的药物的一部分,这种药物通过阻断一种能使血管变窄的激素的作用来起到治疗效果。同时,也有许多此类常用的处方药不在被召回范围之内。消费者可以在美国食品和药物管理局的官方网站上查看被召回药品的完整清单。
制药公司通常都建议患者在停止服用药物前咨询他们的医生或药剂师,因为停止使用被召回的药物可能会比继续使用药物造成更直接的伤害。
这些药物召回事件凸显了美国食品及药物管理局在监管全球药品供应链方面所面临的巨大挑战。在美国销售的80%的药物成分,和40%的成品药物都是在海外三千多家工厂生产或经营的。
在过去十年里,随着制药行业加速了其在海外的生产,有大量外国制药厂并未受到检查监督。美国食品和药物管理局已经开始着手解决这些问题。该局取消了至少每两年对所有国内外制药工厂进行一次普查的政策,而是根据对美国消费者的潜在风险,优先对重点关注工厂进行检查。
美国食品和药物管理局的检查人员在访问了位于中国临海的浙江华海制药厂(Zhejiang Huahai Pharmaceutical factory)后发现,该厂多次未能完成对药品异常批次进行的检查。美国食品和药物管理局在其报告中没有列出所提到的异常药物的名称。
这家中国工厂是近期被召回的血压药物的主要来源,检查人员发现该厂生产设备存在垫圈磨损、螺丝生锈和零件丢失等现象。
尽管被发现存在这些不合格现象,该药厂的运营仍然没有中断。直到去年6月,另一家公司测试了这家浙江工厂生产的药物成分时,发现致癌物亚硝基二甲胺(NDMA)达到了不可接受的水平之后,美国食品和药物管理局在7月份进行了调查并宣布药物召回。
随后的跟踪检测又发现在一批缬沙坦(valsartan)药物中发现还存在第二种致癌物质亚硝基二乙胺(NDEA)。
去年9月,美国食品和药物管理局发布了一项进口警告,禁止该工厂生产的产品进入美国。美国食品和药物管理局在11月发出了一封警告信,警告当药品从一个生产线转到另一个生产线时所面临的杂质控制、变更控制和污染等问题的存在。
美国食品和药物管理局说,浙江的这家工厂并没有针对关于发现致癌物NDMA的初步报告展开足够的调查。
目前还不清楚这家工厂已经生产受污染的药物有多长时间了,直到去年6月才首次被客户发现其产品不合格问题。
2011年11月,浙江这家制药厂的工人们改变了他们生产缬沙坦药物的方式,以期用更低的成本生产更多的产品。美国食品及药物管理局在一封警告信中表示,该工厂未能评估形成致癌物NDMA等有毒杂质的可能性。
自2015年以来,美国食品及药物管理局在海外进行的检查多于在美国国内工厂进行的检查。同时,即使美方的检查人员发现了问题,也不足以阻止受污染的药物进入美国。因为在美国,这些药物由医生开处方,由病人服用。