重组新冠疫苗获批启动临床试验
据央视报道,由军事科学院军事医学研究院陈薇院士领衔的科研团队,成功研制出重组新冠疫苗!
昨天,重组新冠疫苗获批启动展开临床试验。据陈薇院士介绍,按照国际的规范,国内的法规,疫苗已经做了安全、有效、质量可控、可大规模生产的前期准备工作。
陈薇院士说:疫苗是终结新冠最有力的科技武器,这个武器如果由中国率先研制出来,有自己的知识产权,不仅体现中国科技的进步,也体现了我们的大国形象!

工程院院士王军志:正按5种技术路线开展疫苗紧急研制
3月17日,国务院联防联控机制就药物疫苗和检测试剂研发攻关最新情况举行发布会。
发布会上,中国工程院院士王军志表示,中国新冠疫苗研发进展目前总体上处于国际先进行列,不会慢于国外。
新冠肺炎的疫苗研制速度比较快,该如何确保疫苗的安全性?
对此中国工程院院士王军志表示,国内外对疫苗的上市应用具有严格的法律法规和技术标准的要求。目前,我国正按照5种技术路线开展新冠疫苗的紧急研制,各类疫苗在临床前研究的过程、技术特点和要求都有所不同。疫苗进入临床试验必须完成药学方面研究、有效性研究和安全性研究。

王军志介绍说——
首先,是药学方面研究,主要包括菌毒种和细胞库建立、工艺研究和质量标准研究等。主要建立稳定的生产工艺和质量控制标准,以保证制备出合格的疫苗样品。
第二,是有效性研究。获得疫苗样品后,采用感染动物模型(比如新冠病毒的猴感染模型和鼠感染模型)来评价疫苗免疫原性和保护效果,这个结果可用来推算临床研究的剂量和程序。
第三,是疫苗安全性评价。针对新发传染病至少要进行动物单次给药(急性)毒性和重复性给药(长期毒性)评价。
王军志表示,总的来说,首先要生产出合格疫苗样品,在动物实验中证明安全有效性后,才能进入临床试验。国家对于疫苗研发的每个环节,都有相应的技术法规可以遵循,这些法规和技术要求和世卫组织等国际上的标准是一致的。
王军志强调,目前,中国疫苗领域的科学家正按照相关法规和技术要求,一方面全力以赴,争分夺秒,一方面坚持按科学规律办事,在保证疫苗安全性和有效性的前提下,加快疫苗研究应用。“我们正在不断地听到他们传来的好消息,这将为全球最终彻底战胜疫情提供坚实的支撑。”
美国:新冠病毒疫苗跳过动物实验,直接开展人体测试
据环球网援引美国有线电视新闻网(CNN)报道,美国国家过敏症和传染病研究所当地时间16日宣布,美国研发的一种新冠病毒疫苗当天开始进行第一阶段临床试验,首位入组志愿者已接受试验性疫苗注射。
据悉,这种名为mRNA-1273的疫苗由国家卫生研究院下属国家过敏症和传染病研究所和莫德纳公司合作研发,得到国家卫生研究院资助。报道说,临床试验在位于西雅图的凯撒医疗集团华盛顿卫生研究所(Kaiser
Permanente Washington Research Institute)进行,45名年龄在18岁至55岁之间的健康志愿者将参与试验。
美国方面强调,由于疫苗本身不含新型冠状病毒,因此志愿者不可能被感染。
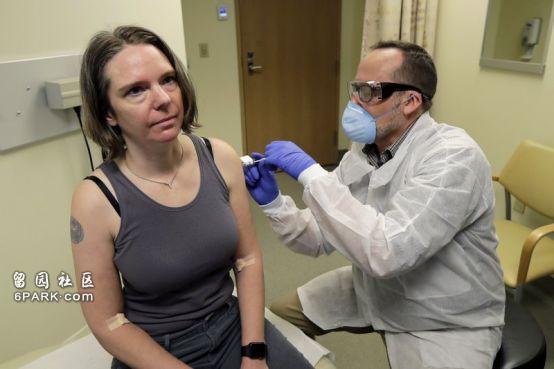
“我们都感到很无助。这对我来说是一个绝好的机会,”詹妮弗·哈勒在接种疫苗前说道。她的两个孩子则认为她参加这项研究“很酷”。注射完疫苗后,她笑着离开了检查室:“我感觉很不错。”
据介绍,下一批接受疫苗测试的是另外3人,最终共有45名志愿者参与此次试验。
美国国家过敏症和传染病研究所所长安东尼·福奇16日在白宫记者会上介绍,志愿者将接受间隔约28天的两次试验性疫苗手臂肌肉注射。他们将分为3组,接受注射剂量分别为每次25微克、100微克和250微克,以便评估不同剂量的安全性以及其诱导人体免疫反应的能力。据介绍,志愿者在完成两次疫苗注射后将接受为期一年的观察。
福奇在声明中表示,此次开启疫苗第一阶段临床试验的速度创下了纪录。应对新冠病毒感染的当务之急就是要研发安全有效的疫苗,这项临床试验是实现这一目标至关重要的第一步。
美国疾病控制与预防中心表示,疫苗通过试验需要一段时间,目前最有效的预防措施是彻底洗手和保持一定的社交距离,避免大规模群体性聚集。
凯撒医疗集团华盛顿卫生研究所负责人丽莎·杰克逊对么米提强调说:“我们不知道这种疫苗是否会引起免疫反应,或者是否安全。这就是为什么我们要进行试验。”她同时表示,“目前还没有可能或审慎将疫苗交给普通大众”。
当地时间16日下午15点30,特朗普在白宫发布会上表示,疫情可能会持续到七八月份,建议美国人今后15天不要从事10人以上的聚集活动,并提示美国经济有可能将出现衰退,之后市场急速下跌。
法匹拉韦效果好,建议尽快纳入诊疗方案
科技部生物中心主任张新民介绍,科研攻关组进一步强化对一线临床救治的支撑和服务。
针对轻型、普通型向重型转化的阻断,重点推动磷酸氯喹、法匹拉韦和中医药;
针对重型、危重型患者的救治,重点推动恢复期血浆、托珠单抗、干细胞和人工肝的临床应用,目前均已取得良好的进展。
其中法匹拉韦已完成临床研究,显示出很好的临床疗效。

鉴于法匹拉韦安全性好、疗效明确、药品可及,经过科研攻关组组织专家充分论证,已正式向医疗救治组推荐,建议尽快纳入诊疗方案。
我国向部分国家提供法匹拉韦、恢复期血浆和中药
张新民表示,病毒无国界,新冠疫情不仅是中国面临的挑战,也是世界各国面临的共同挑战。在疫情发生之后,我国积极探索形成了一系列行之有效的措施。科研攻关组成立了9个专班,围绕疫苗、药物、溯源、检测、动物模型五大技术方向,组织全国优势力量,加快应急攻关,迅速取得了重要的阶段性成果。
张新民指出,中国始终秉承人类命运共同体的理念,愿与国际社会共同分享防控策略、技术成果和标准。
在知识成果分享方面,中国科研团队最早向世界卫生组织共享了病毒全基因序列,国家生物信息中心发布2019新型冠状病毒资源库、国家微生物科学数据中心发布全球冠状病毒组学数据共享与分析系统,为全球病毒基因组序列发布、病毒基因组变异数据分析提供支持。
科技部依托中华医学期刊网,建立了防控新冠肺炎科研成果共享交流平台,目前已有96种期刊上线,平台上有600余篇相关领域研究论文和病理评述,浏览量已超过200万次。
在药物筛选研发方面,中国向世界公开新冠肺炎诊疗方案及药物筛选结果,已向发生疫情的部分国家提供法匹拉韦、恢复期血浆和中药等重点药物。
在疫苗研发方面,我们积极倡导全球合作。目前中国已有多家企业和科研机构与国外开展合作,推进新冠疫苗研发。
中国工程院院士王军志:疫苗进入临床试验要过三道关
(人民日报健康客户端记者 孔天骄)疫苗对疫情防控至关重要,对安全性的要求也是第一位的,新冠肺炎的疫苗研制速度比较快,如何确保疫苗的安全性?3月17日下午,在国务院联防联控机制新闻发布会上,中国工程院院士王军志围绕三个方面进行解答。

王军志提到,国内外对于疫苗的上市应用具有严格的法律法规和技术标准的要求。目前,我国正按照5种技术路线开展新冠疫苗的紧急研制,各类疫苗在临床前研究的过程、技术特点和要求都有所不同。疫苗进入临床试验必须完成药学方面研究、有效性研究和安全性研究。
首先,是药学方面研究。主要包括菌毒种和细胞库建立、工艺研究和质量标准研究等。主要建立稳定的生产工艺和质量控制标准,以保证制备出合格的疫苗样品。
第二,是有效性研究。获得疫苗样品后,采用感染动物模型(比如新冠病毒的猴感染模型和鼠感染模型)来评价疫苗免疫原性和保护效果,这个结果可用来推算临床研究的剂量和程序。
第三,是疫苗安全性评价。针对新发传染病至少要进行动物单次给药(急性)毒性和重复性给药(长期毒性)评价。

人民日报健康客户端记者在国务院联防联控机制新闻发布会上提问
总的来说,首先要生产出合格疫苗样品,在动物实验中证明安全有效性后,才能进入临床试验。
国家对于疫苗研发的每个环节,都有相应的技术法规可以遵循,这些法规和技术要求和WHO等国际上的标准是相一致的。目前,中国疫苗领域的科学家正按照相关法规和技术要求,一方面全力以赴,争分夺秒,一方面坚持按科学规律办事,保证疫苗的安全性和有效性的前提下,加快疫苗研究应用。我们正在不断地听到他们传来的好消息,这将为全球最终彻底战胜疫情提供坚实的支撑。
来源:央视新闻、每日经济新闻、环球网