美国发现肺炎“特效药”,特朗普特批向中国专利豁免,今起临床试验270名病人入组
中国科学报消息,2月1日凌晨,美国科学家在《新英格兰医学杂志》上报道了本土第一例新冠病毒肺炎患者治愈案例,其中提到一种名为瑞德西韦(Remdesivir)的药物。
当天,有消息称,瑞德西韦治疗新型冠状病毒(2019-nCoV)的临床试验将于2月3日在北京中日友好医院启动。
2月2日,中国国家药监局药品审评中心(CDE)正式受理瑞德西韦的临床试验申请。另据外媒报道,美国公共安全卫生部门经特朗普特批,同意将该药物专利豁免,向中国紧急公开药物分子结构至4月27日。
按计划,试验将从2月3日开始,总样本量270例,入组轻、中度新冠肺炎患者。
这次,对抗2019-nCoV的“救命药”真的来了吗?
能否跳过多个环节直接启动临床III期?
瑞德西韦最早是吉利德公司针对埃博拉病毒研发的一款药物,已经在国外完成了I期和II期临床试验。
不过,吉利德公司表示,目前瑞德西韦尚未在任何国家获得批准上市,其针对2019-nCoV的安全性和有效性也未被证实,属于在研药物,没有针对2019-nCoV的数据。
这次,我国将启动的临床试验是III期、随机、双盲、安慰剂对照试验,旨在确定使用瑞德西韦治疗2019-nCoV的安全性和有效性。
据了解,试验总样本量270例,入组轻、中度新冠肺炎患者,由中日友好医院教授曹彬牵头,预期2月3日开始,4月27日结束。
一般来说,换一种不同病毒,就要重新做临床实验,但这次,我国跳过针对2019-nCoV的I期、II期试验,紧急启动了III期临床试验。
北京协和医院感染内科主任李太生在接受《中国科学报》采访时表示,瑞德西韦这个药针对埃博拉病毒的细胞实验是有效的,临床安全性是可以的,但是临床效果数据现在还没有。
但我国紧急启动临床III期,如果是经过国家相关管理部门批准,经过伦理委员会审核,那在一定范围内做是可以的。
国内某知名药企高管也表示,瑞德西韦针对埃博拉病毒的II期临床已经完成,至少说明毒副作用是可控的。埃博拉病毒的临床试验结果或许可以借用到新冠病毒肺炎中,所以可以申请豁免,直接进入III期临床。
据悉,瑞德西韦可以抑制流行性和人畜共患冠状病毒,对埃博拉病毒的作用机制是抑制冠状病毒的RNA聚合酶RdRp。
吉利德公司表示,尽管目前没有抗病毒数据显示瑞德西韦对于2019-nCoV的活性,但在体外和动物模型中,瑞德西韦证实了对非典型性肺炎(SARS)和中东呼吸综合征(MERS)的病毒病原体均有活性。后两者也属于冠状病毒,且与2019-nCoV在结构上非常相似。
真的能成“救命药”吗?
III期临床试验总样本量仅270例,能否确保药物有效?对此,专家认为,需谨慎对待。
李太生表示,现在瑞德西韦的试验属于新药研究,要考虑其存在的风险性。美国的报道是治好一个病人,事实上这是一个个案报道,不能做大的推广。
“我们对抗病毒治疗非常谨慎。即便对于克力芝,我们也是非常谨慎的。克力芝最早是治疗艾滋病的,国际上从2000年开始使用,中国从2008年开始使用,至今也12年了。
但由于目前没有足够的确凿依据证明存在有效的抗2019-nCoV药物,所以对重症病人也是酌情使用克力芝,因为使用它会产生腹泻等消化道不良反应。”李太生说。
上述药企高管表示,用两百多例样本进行试验是有风险的,到底需要多少个病例,每种药物和每一种疾病都不一样,但这次相关部门愿意冒险批准,因为这种药物最大的好处就是有没有效一试就知道,立竿见影。
“新药审批原本是特别冗长的过程,但这次也许会特事特办。目前全世界其他国家都没有这个压力和动力,但中国有。”该药企高管说。
美国药能在中国上市吗?
上述企业高管还表示,对于吉利德公司来说,这次是瑞德西韦上市的机会。
“必须要完成足够多病例的临床才能批准上市,疫情一旦过去,就找不到足够的案例来完成III期临床了。当年的SARS之所以后来药物没有研究出来,就是因为没有足够多的病人完成III期临床。所以他们要抓紧时间,利用现在足够多的病人,赶紧完成临床。”他说。
他介绍,以前有美国公司在研药物在欧洲、日本先上市的案例,但目前没有在中国率先上市的先例,“也许这个可以开先例”。
正式上市前,瑞德西韦能用吗?
吉利德公司表示,正与全球卫生机构密切合作,提供在研药物瑞德西韦用于试验性治疗,以支持应对2019-nCoV感染的暴发。那么,除了270例参加试验的患者外,其他患者是否有可能在瑞德西韦正式上市前用上这种药呢?
这件事要从一个名为“同情用药”的制度说起。
美国治愈的新冠病毒肺炎患者之所以能用这个药,得益于美国的同情用药制度。
所谓“同情用药”是指在一些特殊情况下,患者不能通过参加临床试验来获得临床试验用药物时,允许在开展临床试验的机构内使用尚未得到批准上市的药物给急需的患者。
2017年12月,国家食品药品监督管理总局公布了中国版的同情用药制度——《拓展性同情使用临床试验用药物管理办法(征求意见稿)》。
根据这份意见稿,中国同情用药制度的目标人群是患有危及生命或严重影响患者生活质量需早期干预且无有效治疗手段的疾病的患者。
而且,这一办法规定,注册申请人需向国家食品药品监督管理总局药品审评中心申请开展拓展性临床试验,获得批准后方可实施。
但由于还是征求意见稿,所以,究竟在上市前能不能有更多患者用上这种药,尚未可知。
好消息!美国首例“新冠”患者治疗后大幅好转,国内火速开展三期临床试验,特效药要来了?
新型肺炎疫情的蔓延令人揪心。这个时候,大家都殷切期望制药产业界能尽快发现可以抑制2019-nCoV病毒的药物或预防感染的疫苗。国内外的研发机构和企业也都正在朝着这个目标努力。
2月1日早间,顶尖医学期刊《新英格兰医学杂志》(NEJM)在线发表了一篇关于美国首例新型冠状病毒(2019-nCoV)确诊病例的论文,详细介绍了该患者就医、治疗以及临床表现。
其中最引人注意的是,这名患者在接受了一种叫做Remdesivir(瑞德西韦)的抗病毒药物治疗后,出现了大幅改善,“截至1月30日,患者仍在住院,但除了咳嗽,其他症状都好了,而且咳嗽的严重程度在减轻。”
尽管目前没有抗病毒数据显示Remdesivir(瑞德西韦)对于2019-nCoV的活性,但其针对其它冠状病毒的有效数据给了我们希望。在体外和动物模型中,Remdesivir(瑞德西韦)证实了对非典型性肺炎(SARS)和中东呼吸综合征(MERS)的病毒病原体均有活性,它们也属于冠状病毒,且与2019-nCoV在结构上非常相似。
吉利德科学(Gilead Sciences, Inc)是一家以抗病毒药物而闻名于世的生物制药公司,在过去的20年里,吉利德先后上市了多种抗HIV和HCV药物,抗流感病毒药物达菲也出自吉利德之手。同时,吉利德也致力于支持全球卫生界迅速并有效的应对全球范围内严重和危及生命的病毒感染暴发。
吉利德科学拥有非常耀眼的抗病毒的光辉历史:
1:让艾滋病变为慢性病。患者寿命完全不受影响。最新的药物副作用极低,几乎没耐药。
2:把乙肝病毒控制在极度水平。最新的药物副作用极低,几乎没耐药。
3:把丙肝直接消灭了。现在的临床正在尝试攻克乙肝。还有就是超长效艾滋病药物(一个月一针甚至更长效)
晚些时间,关于这一在研新药在中国开展三期临床试验的消息也已经被公布。该项III期临床试验计划将于2020年2月3日即在中日友好医院正式启动,可谓是火速进行。
01
吉利德抗肺炎药物第一例病人数据极佳雪球用户、资深医药行业研究达人@Stevevai1983对吉利德的抗病毒药物治疗发表了详细解读:
昨天全球抗病毒最牛企业没有之一的吉利德科学公布了第一例病人数据。
他们有一个临床药物叫Remdesivir。本身是用来尝试治疗埃博拉病毒,但是效果不行。同时临床前数据表示对SARS,MERS等冠状病毒效果非常好说明可能对这类冠状病毒有广谱效果。现在肺炎流行,这个已经在埃博拉人体临床过,证明了安全性的“老药”自然会被用来尝试。
这个是美国第一例病人的情况。
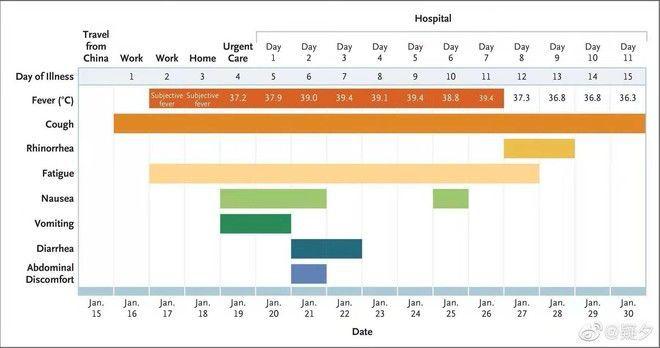
打开APP,查看更多精彩图片
一开始咳嗽(Cough)然后低烧(Fever)2天以后变为38度高烧入院。入院以后肺部开始快速恶化,进入重症状态,开始呼吸机。用了各种抗生素都没用。情况急速恶化。在住院第7天的时候人已经不行了。然后使用了remdesivir。第8天奇迹般的变为37.3度。症状迅速缓解。第9天退烧,只剩下轻微咳嗽,其他症状也缓解。
作为第一个人体案例这无疑是极大的振奋人心。从临床前有强证据到病人效果极佳。吉利德现在准备开展大型双盲临床来证明这药的有效性,从而获批。
我之前就说过,这类病毒的问题一直都是经济效益。花海量的钱用几年时间研发一个药物出来以后疫情早已消失,甚至有可能是永久性消失。时间和金钱全部打水漂。如果一旦这种病毒隐蔽性太强很难消灭,有成为常态的趋势或者扩大到世界级危机那么自然会有药企介入开始研发治疗药物或者疫苗。这类研发的难度远低于让癌症病人多活几个月。所以我从来不担心这类疫情会成为长期因素。
只有2种结局:
1:短期就被控制。
2:长期存在但是有特效药。发现一例就隔离并且用药康复。
02
如果瑞德西韦有效,多久能投入使用?
那么如果吉利德的瑞德西韦确实对新型冠状病毒肺炎有效,最快能在多长时间内投入使用?
雪球用户@不明真相的群众 在雪球就此在雪球上发布了悬赏话题。
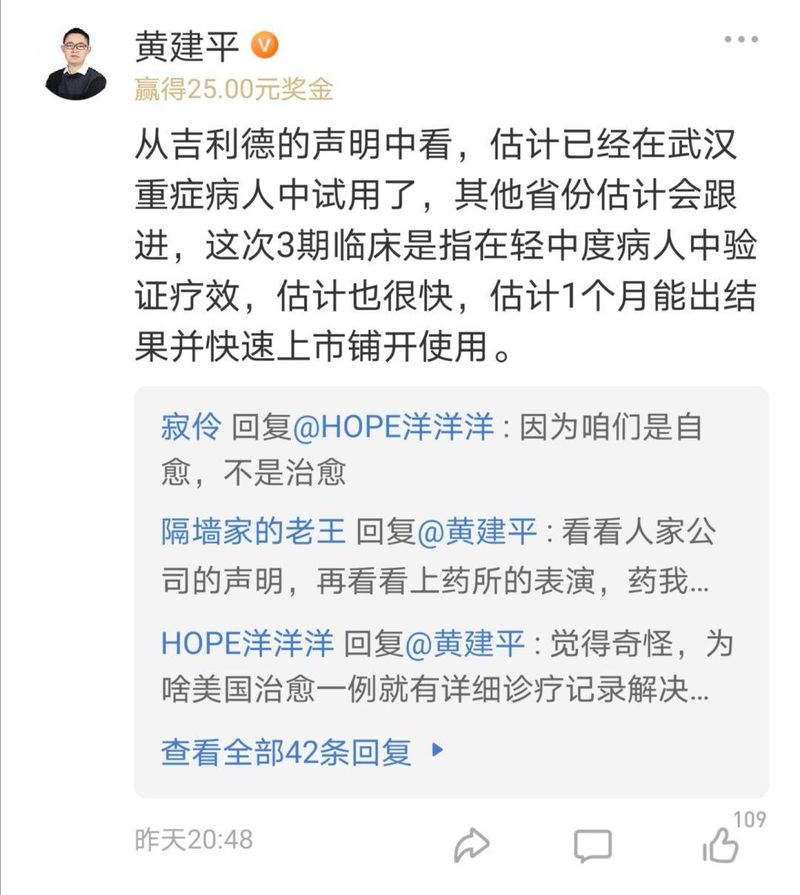
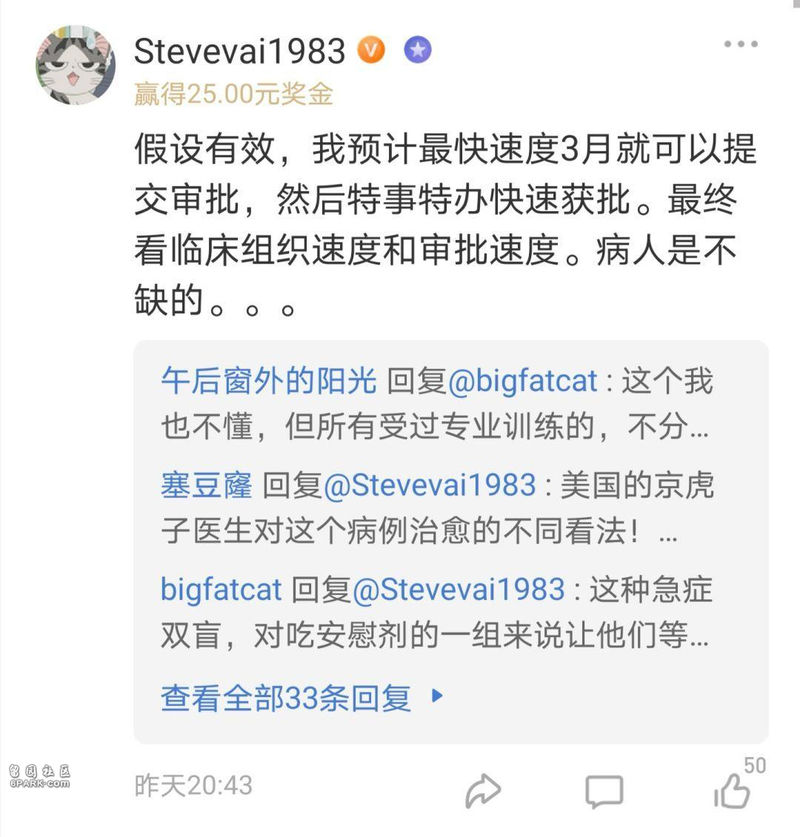
雪球用户@黄建平 @Stevevai1983 均表示,如果验证疗效,可能特效药上市并不需要等很久。
03
除了吉利德的瑞德西韦之外,已有多款药物在研
除了吉利德的瑞德西韦之外,当前在研的抗2019-nCoV病毒感染项目已经有7个。除了最近几天为众人所知的阿比多尔、瑞德西韦(吉利德,RNA聚合酶抑制剂)、法匹拉韦(海正,RNA聚合酶抑制剂)、洛匹那韦(艾伯维,蛋白酶抑制剂)等小分子抗病毒药物外,还有诸如CR3022这样针对S蛋白的大分子单抗药物,只不过还处于临床前研究阶段。
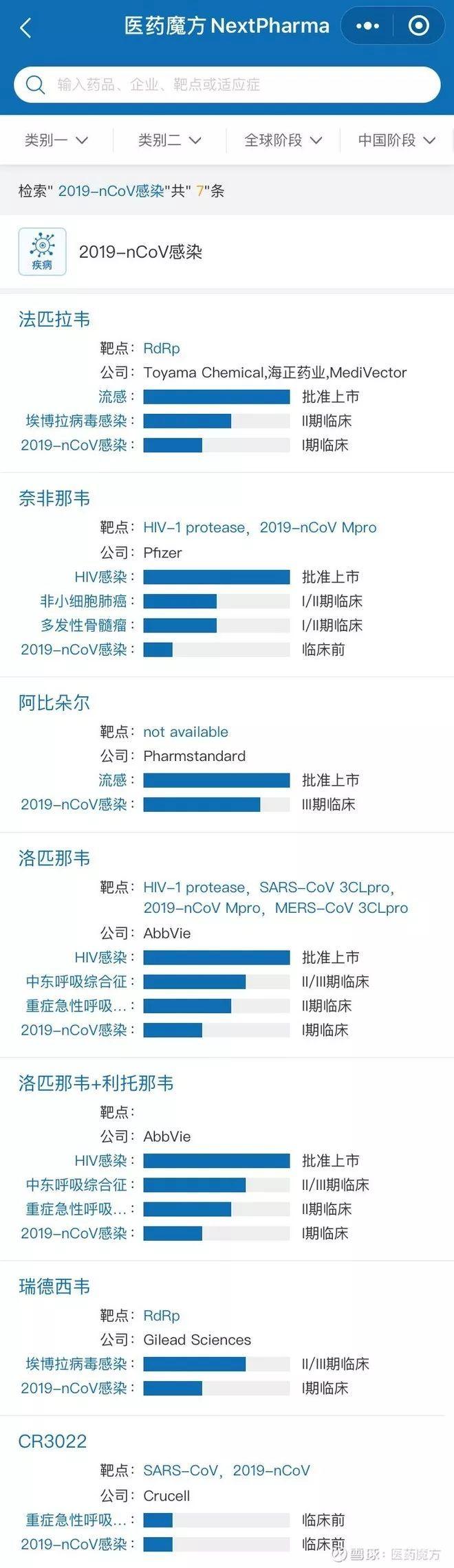
虽然,在获得可靠的疗效和安全性数据之前,Remdesivir可以通过「同情用药」的方式在临床上用于少部分患者,但是针对大量患者的药物还是需要经过临床试验来验证。
兵贵神速,我们看看目前已经登记启动的临床试验有哪些。
以「新型冠状病毒」为关键词在中国临床试验注册中心中检索发现,目前已经登记启动了7项研究,在武汉、广州、重庆、北京等4地开展,试验药物涉及中药、血必净注射液、糖皮质激素、利巴韦林+干扰素α-1b、洛匹那韦/利托那韦+干扰素-α2b等。

上述7项研究涉及的药物

在药物临床试验登记与信息公示平台中未发现针对新型冠状病毒的相关试验登记信息。
以「2019-nCoV」为关键词在医药魔方PharmaGo全球临床试验库中检索发现,目前已经登记启动了3项研究。其中有2项是治疗性研究。一项是来自中南大学湘雅医院开展的阿比多尔治疗研究,一项是北京协和医院发起的甲泼尼龙的治疗研究。
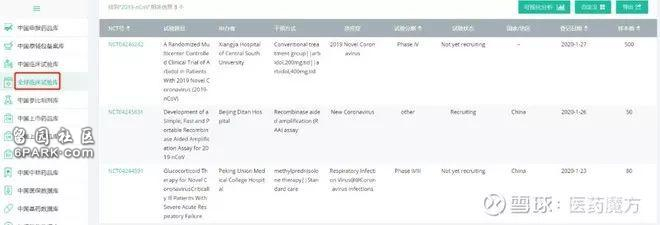
来源:PharmaGo全球临床试验库
据知情人士透露,海正药业正与CDE沟通新型肺炎药物法匹拉韦的审评事宜,准备紧急提交上市申请,走快速审评通道。
新型冠状病毒肺炎在全国乃至全世界范围内愈演愈烈。截至截至2月1日24时,累计报告确诊病例14380例,现有重症病例2110例,累计死亡病例304例,累计治愈出院328例,现有疑似病例19544例。
寻找治疗新型冠状病毒肺炎的药物,成为全球科学家及药企攻关的核心工作。特效药的到来,值得期待!


