好消息!
真真的好消息。
今天,由华盛顿大学医学院Ali H. Ellebedy领衔的研究团队,在顶级期刊《自然》发表论文称:他们在轻症新冠肺炎康复者的骨髓中发现了新冠病毒特异性的长寿骨髓浆细胞(BMPCs,一种效应B细胞)[1]。这种细胞会终生存在,持续释放抗体。
这一发现表明,至少对于轻症新冠康复者而言,新冠病毒在他们体内诱发了强大的抗原特异性、长效的体液免疫反应。
此外,值得一提的是,这也是迄今首次证实病毒感染人类后会诱导抗原特异性BMPCs。

论文首页截图
根据之前的研究我们已经知道,季节性冠状病毒的再次感染一般发生在前一次感染后的6-12个月[2]。这表明人体对这些病毒的保护性免疫力可能是短暂的[2]。
一开始的时候,科学家从新冠肺炎康复者血液样本中发现的现象,让我们以为新冠病毒可能有类似的特点。
例如,有研究发现,抗新冠病毒的血清抗体在感染后的头几个月会迅速衰减[3,4]。这引起了研究人员的担忧,因为这可能意味着康复者体内没有产生长寿BMPCs,毕竟长寿BMPCs是保护性抗体的持久性和基本来源[5-7]。
甚至还有研究人员认为,新冠病毒感染可能无法引起功能性生发中心(主要由B细胞组成)的反应,而这将严重影响长寿BMPCs的产生[8]。
新冠病毒(图源:NIAID-RML)
不过,好消息是,研究人员在分析感染后4至6个月收集的样本时发现:新冠病毒抗体滴度下降较慢[9,10]。而且还有研究发现新冠肺炎康复者再感染的风险明显降低[11,12]。
种种迹象表明,新冠康复者对新冠肺炎应该是有长久的免疫力。
真相究竟如何呢?
Ellebedy意识到,要想弄清新冠肺炎康复者体内是否存在持久的抗体免疫,问题的关键在于骨髓。
得研究骨髓啊朋友们。
与血液样本比起来,骨髓样本的获取可就难多了。
新冠病毒(图源:NIAID-RML)
在Ellebedy的这项研究中,他们一共招募了77个轻症新冠肺炎康复者,其中49%为女性,51%为男性,年龄在21岁到69岁之间,中位年龄49岁。其中有6人接受过住院治疗。
所有的患者从初次感染后约一个月开始,每隔三个月提供一次血样。
最关键的骨髓样本Ellebedy团队也弄到了,在Iskra Pusic的帮助下[13],他们从18名已经确诊感染新冠病毒七八个月了的康复者体内采集了骨髓;4个月之后,其中的5个人又贡献了一次骨髓。作为对照,他们还从11名从未感染过新冠肺炎的人体内采集了骨髓。
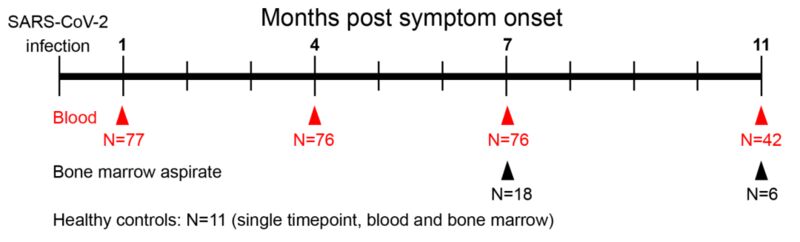
血样和骨髓采样时间
基于上述实验材料,Ellebedy和他的同事发现:新冠康复者血液中的抗体水平在感染后的头几个月迅速下降,然后趋于平稳,有些人甚至在感染后11个月还能检测到一些抗体。这与之前的研究数据基本一致。

血样抗体随时间的变化趋势
接下来就要研究一个重要问题:新冠康复者骨髓内是否存在新冠病毒特异性的长寿BMPCs。
为此,他们从骨髓样本中富集BMPCs,分析2019/2020年流感病毒疫苗、破伤风/白喉疫苗和新冠病毒S蛋白特异性的IgG和IgA的频率。
他们发现,流感和破伤风/白喉疫苗特异性BMPCs的频率,在对照组和康复者之间是相当的。

流感和破伤风/白喉疫苗、新冠病毒S蛋白特异性BMPCs分析
再来看新冠病毒S蛋白特异性的细胞。
在新冠康复者的19个骨髓样本中,有15个含有新冠病毒S蛋白特异性抗体产生细胞,在11名对照组参与者中没有检测到此类细胞的存在。
值得一提的是,在骨髓取样时,所有康复者的血液中都没有检测到S蛋白特异性抗体分泌细胞。这表明研究人员检测到的BMPCs是骨髓驻留细胞,而不是来自循环浆细胞的污染。

流感和破伤风/白喉疫苗、新冠病毒S蛋白特异性BMPCs比较
至于5名康复者4个月后采集的第二份骨髓样本,研究人员发现抗S IgG BMPCs的频率是稳定的,而抗S IgA BMPCs的频率在5人中有4人是稳定的,其中一人下降到检测阈值以下。
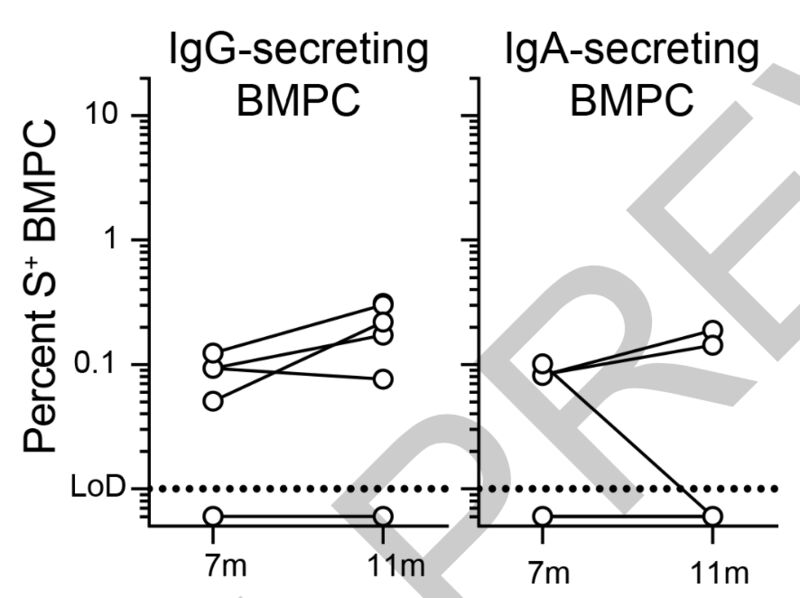
不同时间的新冠病毒S蛋白特异性BMPCs比较
对于自己的研究成果,Ellebedy有自己的理解,他认为[13]:“轻症新冠肺炎患者在感染后两到三周就会清除体内病毒,因此在感染7或11个月后就不会有病毒驱动的活跃免疫反应。”
此外,Ellebedy还认为[13],这些新冠病毒特异性BMPCs处于静止状态,没有在分裂,只是静静地待在骨髓中,默默地分泌抗体,而且它们会无限期地持续这样做。
对于那些无症状感染者,Ellebedy推测他们也有可能留下了长期的免疫力[13]。
不过,对于那些重症感染者是否存在长期免疫力,还有待进一步的研究。第一作者Jackson Turner认为,重症感染者的过度炎症反应可能会导致免疫反应的缺陷,所以不能确定此类患者体内是否存在新冠病毒特异性的长寿BMPCs[13]。
至于新冠疫苗是否会诱导长寿BMPCs的产生,Ellebedy及其同事表示他们正在研究[13]。
相关报道:轻度感染新冠可持久获得保护性抗体!最新权威研究带来力证
日前,顶尖学术期刊《自然》以“加速文章预览”(Accelerated Article Preview)形式在线发表了一篇有关新冠感染的重要论文,为我们带来一项好消息。

圣路易斯华盛顿大学医学院(WUSTL)的研究团队,在对患者进行了骨髓样本的分析后,首次证明了经历轻症的新冠患者在感染后的11个月,体内仍有免疫细胞在生产保护性的抗体。这类免疫细胞——长寿骨髓浆细胞,可以在人的余生中一直存在并产生抗体,带来持久的免疫应答。
“去年秋天曾有报道称,感染新冠病毒后产生的抗体会迅速衰减,很多人猜测这意味着免疫保护无法长久。”这项研究的通讯作者Ali Ellebedy博士解释说,“但这是对数据的误解。经历急性感染以后,抗体水平下降很正常,但不会下降到零,而是会进入稳定阶段。”
Ellebedy博士指出:“我们在这项研究中的发现,是长期免疫保护的有力证据。”

图片来源:123RF
研究人员指出,要弄清楚COVID-19是否会导致持久的抗体保护,关键在于骨髓。这是因为,在感染病毒期间,产生特异性抗体的免疫细胞迅速增殖,并在血液中循环——此时检测到的抗体水平很高。然而一旦感染得到解除,大多数此类细胞就会死亡,于是血液抗体水平就会下降。然而,有一小群产生抗体的细胞,也就是长寿浆细胞,迁徙至骨髓,会在那里持久地分泌抗体,有助于在再次遭遇同款病毒时起到保护作用。
那么,感染新冠病毒的轻症患者是否拥有这类长寿的浆细胞,并且持续产生专门针对新冠病毒的中和抗体呢?为了确认这一点,研究团队共招募了77名轻症患者,进行了为期11个月的追踪分析。

图片来源:药明康德内容团队
这些感染者从最初出现症状起的大约1个月后开始,每三个月进行一次验血。和预期的一样,血液中针对新冠病毒S蛋白的中和抗体,在感染后的前4个月迅速减少;在随后的7个月水平逐渐下降;但在感染后第11个月,仍可以检测得到这些中和抗体。
与此同时,研究人员在其中18名实验参与者感染后的第7~8个月对他们做了骨髓穿刺,分析了骨髓样本中的细胞。检测结果显示,其中大部分(15人)骨髓样本中发现了对新冠病毒S蛋白特异的长寿骨髓浆细胞(BMPC),并且其比例与这些患者的中和抗体滴度有相关性。
有5名参与者在相隔数月后还提供了第二份骨髓样本,仍然可以再次找到S蛋白特异的BMPC,表明这些细胞稳定存在。
作为比较,研究人员还从11位从未感染过新冠病毒的人那里获得了骨髓样本,没有发现同样的BMPC。
“新冠轻症患者在感染后的两三周就能清除体内的病毒,因此在感染后的7~11个月内不会再有病毒引起的主动免疫反应。” Ellebedy 博士解释说,“这些细胞没有分裂。它们处于静息状态,只是待在骨髓中分泌着抗体。从感染结束以来,它们就一直这样做,还将一直继续这样做。”
图片来源:123RF
研究机构的新闻稿指出,新冠轻症康复者可获得持久抗体保护,意味着再次出现COVID-19症状的可能性不大。研究人员推测,那些无症状感染者有可能也获得了持久的保护。
而经历过更严重症状的感染者是否能避免再次感染,研究人员认为还需要进一步研究。“两种情况都有可能。”第一作者Jackson Turner博士说,“在新冠重症中,炎症起了主要作用,炎症过度会导致免疫应答缺陷;但另一方面,病重往往是因为体内病毒太多,而大量病毒可能导致良好的免疫应答。”研究人员表示,还需要在中度和重度感染的患者中重复这项研究,才能更确切地了解答案。
研究人员还在继续研究的另一个重要问题是:接种疫苗,是否也会让我们产生这些生产抗体的长寿免疫细胞。
参考文献:
[1].https://www.nature.com/articles/s41586-021-03647-4
[2].Edridge AWD, Kaczorowska J, Hoste ACR, et al. Seasonal coronavirus protective immunity is short-lasting. Nat Med. 2020;26(11):1691-1693. doi:10.1038/s41591-020-1083-1
[3].Long QX, Tang XJ, Shi QL, et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med. 2020;26(8):1200-1204. doi:10.1038/s41591-020-0965-6
[4].Ibarrondo FJ, Fulcher JA, Goodman-Meza D, et al. Rapid Decay of Anti-SARS-CoV-2 Antibodies in Persons with Mild Covid-19 [published correction appears in N Engl J Med. 2020 Jul 23;:]. N Engl J Med. 2020;383(11):1085-1087. doi:10.1056/NEJMc2025179
[5].Slifka MK, Antia R, Whitmire JK, Ahmed R. Humoral immunity due to long-lived plasma cells. Immunity. 1998;8(3):363-372. doi:10.1016/s1074-7613(00)80541-5
[6].Hammarlund E, Lewis MW, Hansen SG, et al. Duration of antiviral immunity after smallpox vaccination. Nat Med. 2003;9(9):1131-1137. doi:10.1038/nm917
[7].Nutt SL, Hodgkin PD, Tarlinton DM, Corcoran LM. The generation of antibody-secreting plasma cells. Nat Rev Immunol. 2015;15(3):160-171. doi:10.1038/nri3795
[8].Kaneko N, Kuo HH, Boucau J, et al. Loss of Bcl-6-Expressing T Follicular Helper Cells and Germinal Centers in COVID-19. Cell. 2020;183(1):143-157.e13. doi:10.1016/j.cell.2020.08.025
[9].Wajnberg A, Amanat F, Firpo A, et al. Robust neutralizing antibodies to SARS-CoV-2 infection persist for months. Science. 2020;370(6521):1227-1230. doi:10.1126/science.abd7728
[10].Rodda LB, Netland J, Shehata L, et al. Functional SARS-CoV-2-Specific Immune Memory Persists after Mild COVID-19. Cell. 2021;184(1):169-183.e17. doi:10.1016/j.cell.2020.11.029
[11].Hall VJ, Foulkes S, Charlett A, et al. SARS-CoV-2 infection rates of antibody-positive compared with antibody-negative health-care workers in England: a large, multicentre, prospective cohort study (SIREN) [published correction appears in Lancet. 2021 May 8;397(10286):1710]. Lancet. 2021;397(10283):1459-1469. doi:10.1016/S0140-6736(21)00675-9
[12].Houlihan CF, Vora N, Byrne T, et al. Pandemic peak SARS-CoV-2 infection and seroconversion rates in London frontline health-care workers. Lancet. 2020;396(10246):e6-e7. doi:10.1016/S0140-6736(20)31484-7
[13].https://medicine.wustl.edu/news/good-news-mild-covid-19-induces-lasting-antibody-protection/