在辉瑞疫苗取得重大成果的助推下,11月9日全球权益市场涨声一片。
数据显示,截至北京时间11月9日21:32,英国富时100指数、法国CAC40指数、德国DAX指数集体大涨,并创下7个多月来单日涨幅新高,美股期货亦迎来久违大涨;美、布两油双双大涨,站上每桶41美元关口,避险资产黄金盘中价格跌破1900美元/盎司。富时中国A50指数期货夜盘在盘中直线拉升,涨幅接近2%。
消息面上,美国辉瑞表示,大型研究结果显示,辉瑞研制的新冠疫苗阻止了90%的新冠感染。在机构人士看来,未来四大因素仍将利好欧美股市。
疫苗重大利好提振权益市场
受美国辉瑞新冠疫苗出现重磅利好消息影响,叠加美国大选不确定性靴子落地,全球权益市场迎来罕见大涨。
北京时间11月9日晚间,早于美股开盘的欧洲股市迎来罕见大涨。截至21:32,英国富时100指数、法国CAC40指数、德国DAX指数分别大涨5.55%、7.23%、5.61%,均创下7个多月来单日涨幅新高。
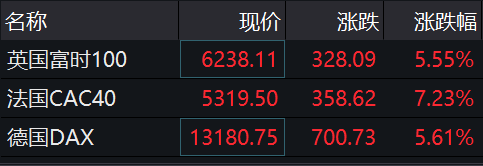
图片来源:Wind
盘前美股股指期货表现亦相当亮眼。英为财情数据显示,截至北京时间21:32,道指期货大涨逾1500点,涨幅达5.62%;标普500指数期货大涨4.40%,但纳斯达克100指数期货涨幅仅为0.70%。

图片来源:英为财情
与股指一同猛涨的还有国际油价。截至北京时间21:32,NYMEX原油、ICE布油盘中涨幅分别达到10.66%、9.63%,价格双双突破每桶41美元关口。
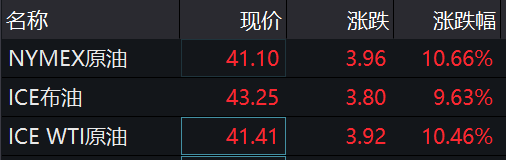
图片来源:Wind
权益市场做多情绪迅速升温,避险资产价格应声下落。截至北京时间21:34,国际金价快速跳水,COMEX黄金价格大跌3%,报1893.1美元/盎司,再度跌破1900美元/盎司关口。
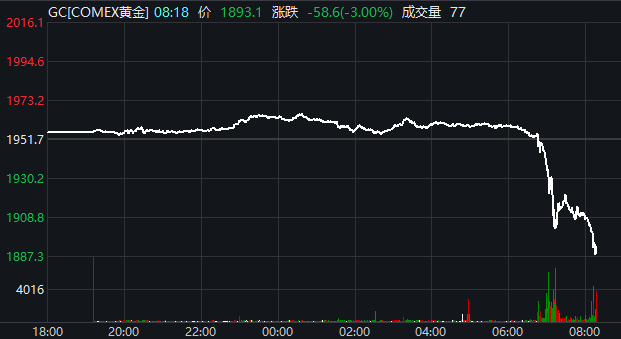
图片来源:Wind
消息面上,据人民日报海外网援引美联社报道,美国辉瑞表示,大型研究结果显示,辉瑞研制的新冠疫苗阻止了90%的新冠感染。
消息传出后,万达旗下美国AMC娱乐控股盘前大涨。截至北京时间21:43,AMC娱乐控股盘前股价报每股4.50美元,涨幅高达80.72%;辉瑞制药盘前大涨逾16%。
四大因素仍将利好欧美股市
工银国际首席经济学家程实指出,从近期美国金融市场表现看,总统选举结果的确定性是主导市场走势最重要的因素,特别在过去一周两位候选人交替领先的计票进程中,无论哪方存在明显优势相对于双方胶着的情形都有助于提振市场风险偏好。当前拜登以高票当选已成定局,不同于一方险胜的情形,明确无争议当选利好风险资产。此外,美国财政刺激出台速度或加快。然而,在过渡期内市场仍需警惕尾部风险。
瑞银财富管理指出,随着美国大选不确定性消失,风险资产将获利好。展望未来,四大因素仍将利好欧美股市:首先,消费者及企业已适应抗疫措施;第二,部分企业三季度盈利回稳且超市场预期;第三,多国继续提供财政支持或失业援助;第四,全球已有10只疫苗进入试验后期,明年第二季度前有望解除抗疫措施。
辉瑞称疫苗阻止90%感染 特朗普、拜登相继表态

海外网11月9日电 据美联社报道,辉瑞公司表示,大型研究结果显示,辉瑞研制的新冠疫苗阻止了90%的新冠感染。特朗普发文称,“股市大涨,疫苗即将上市,报告90%有效。这是多好的消息!”拜登随后也发声明表示,辉瑞的新冠疫苗进展是极好的消息,但距离在美国进行大规模接种还需要数月。
据外媒报道,美国药厂辉瑞(Pfizer)及德国生物技术公司BioNTech9日公布,两家公司合作研发的核酸RNA疫苗,在大规模试验中,阻止了90%的感染。专家曾称,疫苗效用达50%至60%已属可接受。不过辉瑞表示,初步数据显示,测试中的新冠病毒疫苗有效,但不表示短期内疫苗就可以面世。现在的数据有助于向美国监管部门提出申请,在紧急情况下使用疫苗,进一步测试仍在进行。
受消息鼓舞,辉瑞股价市前急升14%,BioNTech更升25%。消息还带动美股期货急升逾千点;标普500指数期货亦升逾4%,高见3648点;纳斯达克指数期货先升后回,升近3%,高见12408点,其后回软;道指期货一度高见29802点,升幅达5.7%。
此前,辉瑞公司曾表示,预计将会在11月下旬在美国申请其正在研发的新冠疫苗的紧急使用授权。如果申请成功,意味著该疫苗可能在今年年底在美国面世。同时,辉瑞还需要约4.4万人规模的临床试验的安全性数据。
目前辉瑞公司正在研发的新冠疫苗是与德国生物技术公司BioNTech共同合作开发的核酸RNA疫苗,但这种疫苗尚无商业化先例,技术和生产工艺以及物流方面仍有待进一步验证
辉瑞新冠疫苗有效性超90%:继续搜集数据,明年产能13亿
辉瑞与BioNTech合作研发新冠疫苗取得重要进展。
11月9日,美国辉瑞公司(NYSE: PFE)在官网发布消息称,与德国BioNTech公司(Nasdaq: BNTX)合作研发的mRNA新冠候选疫苗BNT162b2在没有感染新冠病毒的参与者身上,已经证明了有效性。
BNT162b2疫苗有效率达到90%以上
该结论基于一个外部独立的数据监测委员会(DMC)于11月8日对三期临床试验数据进行的第一阶段中期疗效分析。在这项分析中,参与者是先前没有任何感染新冠病毒证据的健康人群,在这部分人中,BNT162b2候选疫苗有效性超过90%。
辉瑞表示,与FDA讨论后,两家公司最近选择放弃32例中期分析,并至少对62例病例进行了第一次中期分析。讨论结束后,可评估的案件总数达到94例,而DMC对所有案件进行了首次分析。
对接种疫苗者和接受安慰剂者进行分层分析的结果显示,在接种第二剂疫苗后的7天,疫苗的有效率达到90%以上,这意味着在开始接种疫苗后的28天即可获得保护。
不过辉瑞也强调,随着研究的继续,最终疫苗功效百分比可能会有所不同。
此外,辉瑞表示,DMC尚未报告任何严重的安全隐患,并建议该研究继续按计划收集其他安全性和有效性数据,数据将与全球监管机构讨论。
疫苗开发关键里程碑
对于上述新冠疫苗的积极消息,多方表达了观点。
辉瑞公司董事长兼首席执行官阿尔伯特·布尔拉评价,三期临床试验的第一组结果提供了疫苗预防新冠病毒能力的初步证据,疫苗开发计划正在达到关键的里程碑,“今天对科学和人文来说是伟大的一天。”
阿尔伯特·布尔拉还补充道,辉瑞期待在未来几周内分享成千上万名参与者产生的其他功效和安全性数据。
BioNTech联合创始人兼首席执行官Ugur Sahin评价,“这是创新、科学和全球合作努力的胜利。”
实际上,对于BNT162b2在国外的进展,Ugur Sahin在11月6日进博会期间与大中华区合作方复星医药对话时就曾提及,他表示,“我们相信11月末会得到我们所需要的安全性、有效性数据,如果这些数据好的话,那我们就可以证明这是一个非常好的,并且非常有效和安全的产品。我们会向美国FDA申请紧急使用授权(EUA)。”
路透社称,90%的有效性远高于美国食品药品监督管理局(FDA)所要求的50%。
美国总统特朗普在推特上评价,疫苗即将到来,好消息!刚刚赢得美国大选的拜登则表示,尽管有辉瑞疫苗的好消息,离在美国进行大规模接种还需要数月。
BNT162b2新冠疫苗的前世今生:超4万名参与者
今年3月,辉瑞和BioNTech达成合作协议,共同开发新冠mRNA疫苗。
在中国,BioNTech的合作伙伴是复星医药,11月6日,在双方高层的对话活动上,复星医药高级副总裁、全球研发中心总裁兼首席医学官回爱民博士介绍,BioNTech有3个技术平台,第一批进入临床的疫苗共4个,其中BNT162b1和BNT162b2都是核苷修饰疫苗,免疫原性差不多,两者在7月中旬都获得了FDA的快速通道认证。不同的是,前者针对的是S蛋白的受体结合域,后者针对整个S蛋白,“b2的耐受性是比较好的,尤其是老年人”。
根据辉瑞官网披露的消息,作为候选新冠疫苗,BNT162b2自7月27日开始进入三期临床试验,迄今已招募了43538名参与者,截至2020年11月8日,其中38955名参与者已接受了第二剂候选疫苗,约42%的全球参与者和30%的美国参与者具有不同种族和背景。
BNT162b2新冠疫苗临床试验的下一步:继续搜集安全性数据
在发布上述利好消息的同时,辉瑞也表示,新冠疫苗的临床试验正在继续进行中,预计将在总共164例确诊的新冠病例中进行最终分析。这项研究还将评估候选疫苗在先前暴露在新冠环境的人群以及针对严重新冠肺炎提供保护的潜力。
辉瑞还表示,除了评估接种第二剂疫苗后7天确认的新冠病例累积的主要功效终点外,现在的最终分析将包括经FDA批准的新的次要终点,即基于接种第二剂疫苗14天后累积的病例来评估功效。
两家公司认为,增加这些次要终点将有助于使所有新冠疫苗研究中的数据保持一致,并允许在这些新型疫苗平台之间进行交叉试验学习和比较。
辉瑞和BioNTech强调,仍在继续收集安全性数据,目前估计在第二剂(和最后)候选疫苗接种后两个月的安全性数据中值,这是FDA在其潜在紧急使用指南中指定的安全性数据量授权,将于11月的第三周开始。此外,在第二次服药后的两年内,将继续对参与者的长期保护和安全性进行监测。
辉瑞和BioNTech计划提交完整的3期临床试验数据,以发表科学的同行评审。
新冠疫苗的生产:2021年或达到13亿剂
除临床试验产生的功效数据外,辉瑞和BioNTech还表示,在努力准备必要的安全性和生产数据,以提交给FDA,以证明所生产疫苗产品的安全性和质量。
两家公司称,根据目前的预测,预计到2020年全球将生产多达5000万剂疫苗,到2021年将生产多达13亿剂疫苗。
早在今年7月份,辉瑞就先后与英国政府、美国政府达成疫苗交付协议,在获得监管部门的批准或授权下,预计在2020年和2021年交付3000万剂新冠疫苗给英国政府,美国政府则向辉瑞支付了19.5亿美元,以在美国生产和交付1亿剂新冠疫苗。
BNT162b2新冠疫苗在中国
如前文所说,BioNTech和复星医药在大中华区达成开发新冠疫苗的合作,虽然复星医药首先选择了BNT162b1推进临床试验,但对BNT162b2依然拥有商业化权利。
在11月6日的对话中,Ugur Sahin也提到,“基于国际化的合作开发,海外的2b/3期临床试验数据也将同步分享给复星医药,以推动BNT162b2候选疫苗未来在中国的临床试验及上市申请。”
回爱民则提到,“目前在中国进行的BNT162b1临床Ⅰ期试验为后续BNT162b2 的桥接试验积累了宝贵经验。
“即使将来上市的是BNT162b2,BNT162b1的临床数据也需要提交,不存在浪费资源的问题,因为申请BNT162b1时,还没有BNT162b1和BNT162b2的临床一期对比数据,当时先申请数据更多的BNT162b1,也是很自然的决定。”
随着新冠疫苗的研发不断推进,产能供应问题备受关注。今年9月,BioNTech收购了来自诺华制药的德国马尔堡工厂,对现有产能有了极大的补充。
在此次活动上,Ryan Richardson表示,新冠疫苗要实现规模化的生产,收购马尔堡工厂补充了BioNTech现有的生产能力,“在收购马尔堡工厂后,可促进新冠疫苗产能增加最高达7.5亿剂每年。”
Ryan Richardson 强调:“这个角度来看,可以确保对于中国的疫苗供应。但是从长期来看我们会和复星医药共同讨论在中国设厂的可能性。”
对于新冠疫苗的产能,吴以芳介绍,“当前第一阶段肯定从国外进口,第二阶段探讨疫苗原液进口在中国灌装,未来复星医药和BioNTech将持续探讨mRNA技术领域更深远的战略合作。”
辉瑞:计划下周向美国FDA提交疫苗紧急使用授权
11月9日,美国制药巨头辉瑞公司(Pfizer)在官网发布消息称,其与德国生物新技术公司(BioNTech)合作研发的mRNA新冠候选疫苗BNT162b2在没有感染新冠病毒的参与者身上,已经证明了超过90%的有效性,效果好于预期,并且远高于美国食品药品监督管理局(FDA)所要求的50%。
对此,辉瑞公司9日回复澎湃新闻的采访时称,该公司计划在11月的第三周向美FDA提交紧急使用授权,此外预计在2020年将生产5000万剂疫苗,到2021年将生产多达13亿剂疫苗。
在澎湃新闻此前对全球疫苗的梳理报道中曾提到,该款疫苗与美国莫德纳公司研发的疫苗一样走在该国疫苗研发的前列,是在美国率先进行新冠疫苗三期试验的四家公司之一。辉瑞疫苗研发团队从刚获得新冠病毒基因组测序到让第一个志愿者注射该团队研发出来的疫苗(编注:即临床试验第一阶段),仅用了不到66天时间。7月27日,该疫苗进入2/3期临床试验阶段,同时还得到了美国政府以19.5亿美元预定1亿剂新冠疫苗的大额订单。
9月,现任美国总统特朗普在福克斯一档电视节目中公开表示,他最看好辉瑞公司研发的疫苗,并可能率先获得批准上市。
11月9日,辉瑞疫苗有效率超90%的消息,提振的全球的信心,在这一消息的影响下,当天美股开盘大涨。辉瑞首席执行官阿尔伯特(Albert Bourla)在一份声明中说,我们在为全世界的人们提供结束这场全球健康危机的突破举措上迈出了重要一步。
然而,这一消息到底意味着什么?这款疫苗研发细节如何?研发到了哪个阶段?我们该如何看待疫苗有效率和最终获批上市的关系?mRNA技术研发的疫苗比传统疫苗效率更高,但目前还没有国家批准过mRNA疫苗上市,是否有证据证明我们未来可以安心使用这款疫苗?我们是否离获得一款安全有效的疫苗更进一步了?
消息公布后的第一时间,澎湃新闻就上述部分问题采访了辉瑞公司。
计划在11月第三周向美FDA提交紧急使用授权
澎湃新闻:可以简单介绍一下辉瑞和BioNTech目前正在合作研发的这款mRNA疫苗的情况吗?
辉瑞公司:我们的BNT162项目是基于BioNTech的专利mRNA技术,这是一种新型的技术平台,提供了效率和灵活性,从疫苗开发的速度和它所支持的前所未有的试验设计中可以明显看出这一点。
辉瑞公司和BioNTech SE签署了一项全球合作协议(不包括中国,BioNTech与中国的复星医药的合作属于另一范畴),共同开发BioNTech潜在的、基于mRNA的新冠病毒疫苗项目BNT162,旨在预防新冠感染。我们正在以前所未有的速度开发、测试和制造这种潜在的基于mRNA的疫苗,并利用数十年的科学专业知识来开拓疫苗的发现和开发领域,以应对这一全球性健康危机。如果辉瑞与BioNTech的合作最终研发出一种安全有效的疫苗,其目标便是在全球范围内提供疫苗。
辉瑞之所以选择基于mRNA技术的疫苗,是因为该技术具有高效、安全、快速开发和生产的潜力。由于mRNA平台在修改与病毒序列相匹配的编码抗原方面的效率高,以及在任何需要时重复给药的潜在能力,基于该技术研发的疫苗对于(解决)新冠大流行可能具有特殊的效用。
澎湃新闻:能否进一步介绍一下这款研发团队目前所达到的成果以及三期临床试验的现状?
辉瑞公司:根据三期临床研究中由外部独立的数据监测委员会(DMC)于11月8日进行的第一次也是目前唯一一次中期疗效分析(编注:所谓中期分析是在接种了两剂疫苗或安慰剂的43000多名志愿者中,对94名新冠确诊病例进行研究)显示,确定了这款疫苗在没有SARS-CoV-2(新冠病毒)感染证据的志愿者中被证明对(预防)COVID-19(新冠肺炎)有效。
首次中期疗效分析评估了94例已确诊的COVID-19病例,这些患者均为16至85岁的无SARS-CoV-2感染史的志愿者。
在首次中期疗效分析中,在没有SARS-CoV-2感染证据的志愿者中,发现候选疫苗对COVID-19的预防效果超过90%。
该研究将按计划继续进行,直到累计至少164例病例后进行最终的一级和二级终点疗效分析。
澎湃新闻:在疫苗研发之外,辉瑞向美国监管部门提出紧急批准申请之后的下一步计划是什么?新闻称,目前辉瑞还需要约4.4万人规模的临床试验的安全性数据,能否介绍一下今后达到这一步的具体步骤有哪些?是否有计划在未来几周内分享成千上万名参与者产生的其他功效和安全性数据?
辉瑞公司:我们计划在达到所需的安全里程碑后不久,立即向美国食品药品监督管理局(FDA)提交紧急使用授权(EUA),目前预计将在11月的第三周进行。此外,在志愿者获得二次免疫后,我们将继续对他们是否得到长期保护进行监控,并持续收集两年的安全性数据。
mRNA疫苗尚无商业化先例,质量如何保障??
澎湃新闻:能否介绍一下辉瑞目前跟美国政府以及各个国家和企业的合作情况?哪些国家或机构预订了辉瑞疫苗,分别花了多少钱预订了多少剂量?
辉瑞公司:根据目前的预测,我们预计在2020年将生产多达5000万剂疫苗,到2021年将生产多达13亿剂疫苗。如果我们的候选疫苗研发成功,我们将按供应协议在2020年交付部分剂量给各个国家,并按比例分配2020年的可用剂量。
将剂量分配给一个国家内的适当人群是地方政府根据相关卫生当局指南制定的决定。我们致力于与政府合作,以支持公共卫生需求,但我们认为,应与全球公共卫生准则保持一致,优先考虑一线卫生保健工作者,基本工人,免疫力低下的人,疗养院和公共安全官员。
澎湃新闻:mRNA疫苗尚无商业化先例,技术和生产工艺以及物流方面仍有待进一步验证,辉瑞如何克服这一难题,什么样的标准可以让我们安心使用mRNA疫苗?
辉瑞公司:辉瑞公司是一家公认的,可靠的跨国疫苗生产商,为165个以上的国家提供疫苗。如今,辉瑞公司生产了超过2亿剂疫苗,并且是世界上最大的无菌注射剂供应商之一,每年生产超过10亿单位的无菌疫苗。辉瑞有信心迅速扩大生产能力和分销基础设施,利用美国和欧洲的多个生产基地,带来大量高质量的COVID-19候选疫苗。
我们坚持我们的承诺,只有经过设计和实施符合专家监管机构(如FDA)要求的三期临床研究,在证明安全性和有效性后,我们才会提交批准或紧急使用授权。
试验的进展由辉瑞和一个独立的外部数据监测委员会(DMC)密切监控。试验调查员还负责监测受试者的健康状况,作为试验的一部分,试验参与者有定期计划的随访。
我们看到全世界都在关注科学创新的作用,这是一个很好的机会,可以让人们了解生物制药行业和整个科学生态系统的工作,从而推动潜在治疗方法和疫苗研发的发展。
考虑到重要的公共卫生问题和透明度的重要性,我们已经提供了清晰的新冠疫苗研发时间表,与所有其他疫苗一样,必须在三个方面证明疫苗成功有效,我们才能寻求批准疫苗供公众使用,这三个方面是:
首先,必须证明疫苗有效,这意味着它至少可以帮助大多数接种疫苗的患者预防COVID-19疾病。
第二,同样重要的是,必须证明疫苗是安全的,并具有成千上万名患者的可靠安全性数据。
最后,我们必须证明疫苗可以始终以最高质量标准生产。
澎湃新闻:辉瑞是否参与了“新冠肺炎疫苗实施计划”(COVAX)?
辉瑞公司:辉瑞坚定地致力于为全世界所有人提供公平且负担得起的COVID-19疫苗。我们认为,这是一项集体责任,需要公共和私营利益攸关方采取高度协调和协作行动,以结束COVID-19大流行。
在认识到这场新冠大流行的性质后,我们认识到有必要建立一个全球机制,以确保全球能够迅速、公平地获得安全有效的COVID-19疫苗。我们支持建立COVAX,使全世界的人都能公平获得疫苗。
我们还支持在COVAX中纳入预先市场承诺(AMC),作为为低收入和中低收入经济体采购COVID-19疫苗的融资机制。