10月21日,顶尖学术期刊《科学》同时上线两篇研究论文, 由多国科学家组成的两支科研团队背靠背地发现,有一个过去未知的关键因素增强了新冠病毒(SARS-CoV-2)感染宿主细胞的能力:除了众所周知的ACE2受体外,宿主细胞上另一种叫作 神经纤毛蛋白(Neuropilin-1,简称NRP1)的受体,同样会与新冠病毒的S蛋白相结合,作为辅助,把病毒“拉”入细胞。
这一突破性的发现不仅有助于理解 为什么新冠病毒比SARS病毒具有更强的感染性、造成的症状更复杂,同时也指出了 新的潜在靶点,对于开发抗新冠病毒的药物有重要意义。

研究人员在论文中指出, 与SARS相比,新冠病毒造成的疾病症状更为复杂、传播性更强。不像SARS仅限于下呼吸道系统感染,新冠病毒会感染鼻黏膜在内的上呼吸道系统,因此通过打喷嚏等方式会造成病毒主动脱落、迅速扩散。而且,新冠感染影响多种器官(如肺和肾脏), 还会引发神经症状 ,包括嗅觉和味觉暂时丧失。
这种差异引起了科学家们的重视。然而,从病毒感染人体细胞的过程来看,两种冠状病毒都会识别并结合人体细胞的ACE2受体,进而打开细胞的大门。“我们的研究起点是, 为什么同样结合ACE2受体,它们引起的疾病不同?” 其中一支研究团队的负责人、慕尼黑工业大学的Mikael Simons教授说。
图片来源:药明康德内容团队制图
两支研究团队都把目光投向了S蛋白。S蛋白是新冠病毒用来识别细胞的“攻城锤”,也是目前开发抗病毒疗法和疫苗的关键。 新冠病毒的S蛋白有一个不同于SARS病毒的显著特点:具有弗林蛋白酶切割位点。人体内的弗林蛋白酶因此可将新冠病毒S蛋白切割成S1和S2两个亚单位。
仔细查看被弗林酶切割后的末端序列, S1亚单位上的一小段氨基酸吸引了他们的注意:从序列来看,这段氨基酸和人类蛋白质中与NRP-1相结合的序列一致。
随后, Simons教授领导的研究小组使用体外培养的细胞证明, 存在ACE2的情况下,NRP-1可以促进病毒感染。而这段序列发生突变后,NRP1便不能起到增强病毒感染的作用。
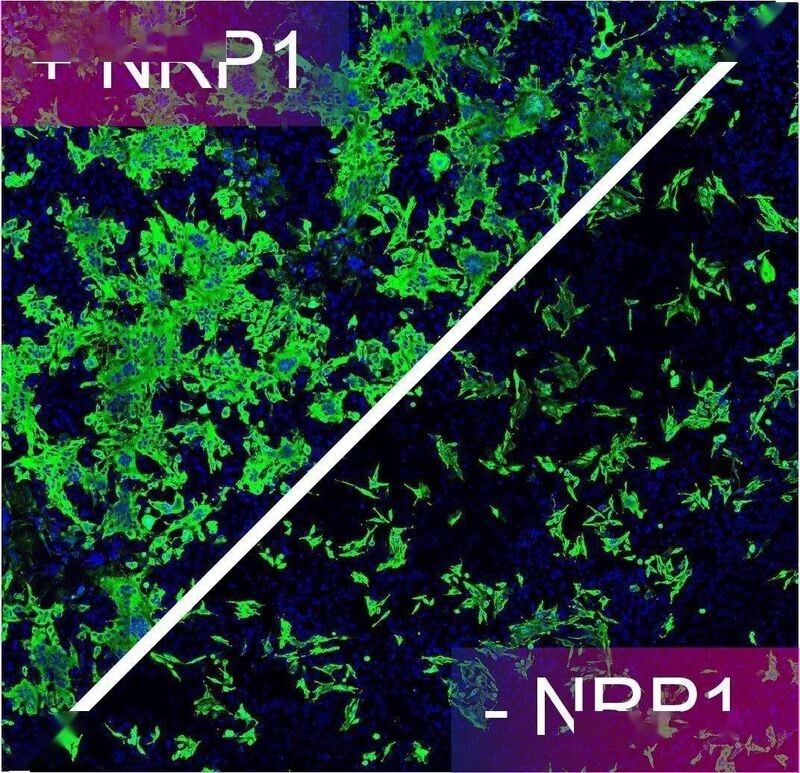
▲图中绿色的是被新冠病毒感染的人类细胞,在没有宿主因子NPR1的辅助时,病毒的 感染性大大降低(图片来源:参考资料[1])
“ 如果把ACE2视为进入细胞的大门,那么NRP1或许就是把病毒带到门口的因素。”Simons教授解释说,“在大多数细胞中,ACE2的表达水平很低,因此病毒要找到进入细胞的大门并不容易,而像NRP-1这样的辅助因子可能是病毒必需的。”
这支研究团队还对一些新冠死亡患者进行了尸检分析。 新冠患者中常见嗅觉障碍问题,而对感染者鼻腔组织样本的分析结果果然发现, 高表达NRP1的嗅上皮细胞和嗅神经细胞会被新冠病毒感染,这进一步确认了NRP1在病毒感染中发挥作用。

▲患者的鼻腔样本组织显示,新冠病毒感染了NRP1阳性的嗅上皮细胞(图片来源:参考资料[1])
另一支英国布里斯托大学主导的研究团队采用一系列结构和生化方法,同样确认了新冠病毒S蛋白与NRP1有直接的相互作用。
更重要的是,在体外培养的人类细胞系中,两支研究团队分别 采用针对NRP1的单抗或选择性NRP1抑制剂,以阻止S蛋白与NPR1的相互作用,实验结果都显示,新冠病毒的感染性得到明显下降。
研究人员在论文中总结说,这些结果表明,“针对新冠病毒S蛋白与NRP1的相互作用,可以为遏制COVID-19大流行提供一条过去未知的途径。”
参考资料
[1] James Daly et al., (2020) Neuropilin-1 is a host factor for SARS-CoV-2 infection. Science. DOI: 10.1126/science.abd3072
[2] LUDOVICO CANTUTI-CASTELVETRI et al., (2020) Neuropilin-1 facilitates SARS-CoV-2 cell entry and infectivity. Science DOI: 10.1126/science.abd2985
[3] Coronavirus: Study finds further door opener into the cell. Retrieved Oct. 21, 2020, from https://medicalxpress.com/news/2020-10-coronavirus-door-cell.html
[4] Neuropilin-1 drives SARS-CoV-2 infectivity, finds breakthrough study. Retrieved Oct. 21, 2020, from https://medicalxpress.com/news/2020-10-neuropilin-sars-cov-infectivity-breakthrough.html


