近日,重庆女孩沈倩因突发疾病致脑死亡离世。悲痛之余,她的父母决定捐献出女儿的肝脏、肾脏和眼角膜,让6人重获新生。
器官移植,是人体器官衰竭后的最后一根“救命稻草”。在中国,每年有30 万人在生死边缘排队等候器官移植,只有1万余人能通过器官移植获得新生。

四川省成都市,一位医务人员用人体器官运输专用箱保存并转运所需器官至手术间。
文 | 韩明月 北京大学科学技术史博士生
编辑 | 王乙雯 瞭望智库
本文为瞭望智库原创文章,如需转载请在文前注明来源瞭望智库(zhczyj)及作者信息,否则将严格追究法律责任。
前不久,国家卫生健康委员会印发了2020年版《人体器官移植技术临床应用管理规范》。本次印发的《管理规范》是我国开展人体肝脏、肾脏、心脏、肺脏、胰腺、小肠等六种人体器官移植技术的基本要求,取消了开展人体器官移植技术的医疗机构等级限制。同时,加强了医疗机构人体器官移植技术临床应用管理的要求。
20世纪50年代早期,移植的概念只存在于科幻小说中;到20世纪60、70年代,医学界已进行了多种器官的移植,在诸多失败中取得了一些辛酸的成功。直到1983年环孢素获批之后,才出现了真正意义上成功的器官移植。
目前,全世界每年进行几十万例器官移植手术,几十万条生命得到了延续。这些成就的背后是许多先驱者的坚持,和更多患者的奉献。
1
走入歧途的先驱者
1894年6月24日,一场宴会散席后,时任法国总统卡诺(Marie-François-Sadi Carnot)被当街刺杀,一名意大利无政府主义者用匕首刺中了他的门静脉,最终这位总统不治身亡。
如果放到现在,或许一场及时的外科手术就能把他从鬼门关拉回来,但当时的医生并不知道如何把断裂的血管缝合起来,对于血管受伤的标准处理方法仅仅是把流血部位结扎(这种办法一直沿用到第二次世界大战)。
当时正在法国里昂进行外科实习的阿历克西斯·卡雷尔(Alexis Carrel)野心勃勃地要解决血管吻合的问题。他在裁缝店里找到了更适宜缝合血管的工具,并把针线浸在液体石蜡里,使它们能更容易地穿过人体组织;最重要的是,他发明了能高效地将两条血管吻合起来的“三线缝合”法。

阿历克西斯·卡雷尔(Alexis Carrel)。
1902 年,卡雷尔在一篇论文里描述了自己的发现。之后的十几年间,卡雷尔先后在芝加哥大学、洛克菲勒研究所等机构开展研究,致力于血管重建和器官移植的动物实验。“卡雷尔瓣”(Carrel patch)也是他的发明,这是一种把血管和主动脉壁切开以增大可缝合长度的技术,这些技术至今仍被应用于器官移植手术中。
在移植方面,卡雷尔多次尝试同种动物间的移植和不同种动物间的移植。虽然没有成功,但他敏锐地发现了移植物和接受移植的动物之间存在的问题,并表示需要在移植之前调控供体器官,或者对受体进行某种调节,以让供体器官适应接受移植的动物的血清,这一想法比“免疫排斥”的概念早了几十年。他甚至想到了,将射线或者苯这样的化学物质应用到移植接受者身上,减少淋巴细胞的数量,以延长移植物在受体身上的寿命——这种方法在几十年后真的被用于移植后抗免疫排斥。
1912年,卡雷尔获得了诺贝尔奖,“以表彰他在血管缝合以及血管和器官移植方面的工作”。卡雷尔似乎迎来了人生的“高光时刻”。但第一次世界大战之后,他被揭露将一些微小进展描述为重大突破而博取眼球,加上他的一些实验设计不佳,研究成果急速下坡。第二次世界大战前后,他全力支持优生学,支持通过选择性繁殖来改善“人口质量”,和查尔斯·林德伯格成为挚友,并回到法国加入维希政府麾下。二战结束后,他因心脏病发于1944年11月去世。虽然没有因其与纳粹分子的亲密关系而被指控任何罪名,但他的名声彻底毁了,在移植方面的许多贡献也被遗忘。但不论如何,卡雷尔对血管吻合的贡献,以及早期器官移植的尝试和“免疫抑制”的猜想,为之后器官移植的发展和实现提供了重要前提条件。
2
梦想照进现实
肾移植的实现
二战时期,一名荷兰医生的创新与坚持为移植在临床上的应用打开了一扇门。
威廉·科尔夫(Willem Kolff)出生于荷兰莱顿,从医学院毕业后,精于机械的他发明了许多临床上应用的器具来帮助病人。科尔夫曾亲眼目睹一名慢性肾病患者死在他面前,于是决心制造一个能暂时替代肾脏功能——也就是滤过血液中的尿素等有害物质——的机器。

威廉·科尔夫(Willem Kolff)。
1942年,科尔夫造出了世界上第一台透析机。这台机器是个看起来笨重的大家伙,但原理很简单,血液流过玻璃纸管,玻璃纸周围的透析液会把血液中的尿素和电解质“拉”进透析液中,从而起到净化血液的作用。此后经过不断改进,1945年,科尔夫成功为一名67岁的女性胆囊炎患者实施透析,她已经8天几乎没有排尿了。透析一天后,她的肾脏开始自主产生尿液,肾功能逐渐恢复。
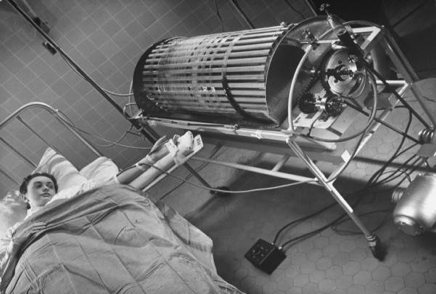
正在使用科尔夫的透析机进行肾透析的患者。
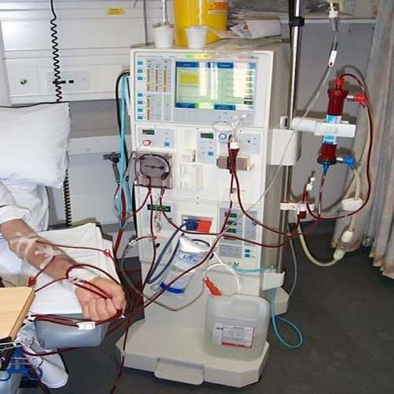
现在的透析机。
科尔夫发明透析机后,慷慨地向世界各地提供机器的制造图纸,其中包括施行第一例成功肾移植手术的美国波士顿的布莱根医院。
布莱根医院的约翰·梅里尔(John Merrill)和戴维·休姆(David Hume)负责透析机的制造、测试和改进,他们在血液透析方面的成功很快为医院吸引了大批年轻的肾衰竭患者。1951年,休姆被任命为布莱根医院肾移植团队的组长,很快约瑟夫·默里(Joseph Murray)加入。在休姆的领导下,布莱根医院在1951-1954年之间进行了9次肾移植,但移植肾长期存活的数量是0。休姆详细记录总结了每个病例的情况,无疑对认识肾移植起到了重要作用。朝鲜战争的尾声时刻,休姆被征召入伍,默里接管了移植团队。

赫里克兄弟(前排)和布莱根医院的医生们(后排),从左往右依次为约瑟夫·默里(Joseph Murray)、约翰·梅里尔(John Merrill)以及哈特维尔·哈里森(Hartwell Harrison)
1954年秋,一对双胞胎赫里克兄弟来到布莱根医院。兄弟中的理查德患有慢性肾病,他的医生知道布莱根医院有一群执着于肾移植的“疯子”,于是把理查德转到这里,想或许可以让健康的罗纳德为自己的兄弟捐出一个肾。“让一个完全健康的人捐出一个肾脏”的想法在当时引发了十分激烈的讨论。这种做法无疑违背了医生“第一,不伤害”的誓言,更何况在上个世纪50年代,肾移植从未成功过,无论在动物还是人身上。但对于理查德来说,移植是唯一可能存活的希望,罗纳德做出了自己的信仰之跃——同意捐肾。
手术前,默里做好了万全准备,为兄弟俩进行了交换皮肤移植,确定移植物没有出现任何排斥反应;他甚至提前用尸体完成了两次肾人体移植的练习。1954年12月23日,默里干净利落地在1个半小时内完成了供体肾和受体的连接,肾脏很快恢复了漂亮的粉红色,不久开始有尿液从输尿管流出。世界首例成功的器官移植,他们做到了。术后,理查德又活了8年,他原来的肾脏疾病在移植肾上又复发了,最终死于肾衰竭。而捐献者罗纳德,手术56年后去世,享年79岁。
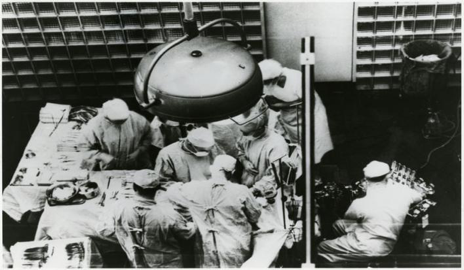
1954年12月23日,美国波士顿布莱根医院,约瑟夫·默里(左三)正在进行首例成功的器官移植手术。
实现了同卵双胞胎之间的肾移植后,默里又将目光转向了把移植推广到大量没有同卵双胞胎的肾衰竭患者身上。
上世纪50年代,对战争中遭受过核辐射的幸存者进行的研究发现,辐射可以破坏免疫系统,或许可以将其应用于器官移植中。1958-1959年,默里进行了12例非同卵双胞胎的肾移植,其中第三个病例在辐射和类固醇的共同作用下,移植肾慢慢正常工作,这个病例和移植肾共同生活了29年。但12例中仅此一例获得了成功。之后在1962年,默里还完成了世界首例移植器官来自死亡捐献者的移植手术,在这个病例中,移植肾存活了21个月,最终它的新主人死于肝炎。
1990年,默里因在人体器官和细胞移植研究方面的贡献而获得诺贝尔生理学或医学奖。
随着肾移植的成功,一直在移植外科苦苦坚持的医生们大受鼓舞,纷纷开始在其他器官的移植上发力。其中最为传奇的可能要数心脏移植。
3
最传奇的心脏移植
很长一段时间里,医生们对于心脏的疾病一筹莫展,毕竟给心脏开刀无异于一场确定的谋杀,更不要提心脏移植——你能想象把一个人的心脏取出来,放进另一个人的胸膛里,然后让它继续跳动吗?
但事实是,在世界首例器官移植成功后仅13年的1967年,首例心脏移植就成功实现了。在进入心脏移植的故事之前,先来看一下让心脏移植变为现实的大功臣——人工心肺机的发明,这也是在疫情期间广为人知的ECMO(体外膜肺氧合)的前身。
打开心脏
1930年10月,一次失败的肺动脉切开取栓术(Trendelenburg手术)让约翰·吉本(John Gibbon)开始思考,能否发明一种机器临时代替心肺的功能,让血液排出二氧化碳、注入氧气,将静脉血变成动脉血,再输回人体内。
1934年,吉本获得了麻省总医院的经费,资助他进行一年的心肺机研究。在作为实验室技术员的妻子的帮助下,吉本用了整整一年完善、试验这台机器,终于在一年期将至的时候成功在实验猫身上完成了维持生命的体外心肺循环。

吉本和妻子玛丽在心肺机旁。
1941年,吉本将机器改造成可以适用于更大体型动物的尺寸,但在此关键时刻,二战爆发,他应召投身战场,研究被迫中断。从战场归来后,吉本获得了IBM的资金和技术支持,他的机器改进得很快,特别是加入了在血流中制造湍流的设计,提高了血液与空气的接触面积,提高了氧合效率。
1952年,吉本第一次在人身上试验完全的体外心肺循环,但未成功。1953年5月6日,吉本用心肺机成功为一名18岁的女孩完成了房间膈缺损修补手术,心肺机为这名女孩提供了26 分钟的临时体外循环。同年,他又进行了两次手术,均未成功。患者接连死亡的打击让吉本心灰意冷,他宣布停止使用心肺机,不再进行心脏手术。
坚持了二十多年,在距离珠峰只有一步之遥的地方,他止步了。他把心肺机的图纸寄给了梅奥诊所的约翰·柯克林(John Kirklin),后者对心肺机继续改造,在1955年完成了8例手术,4名患者存活。

吉本在用心肺机做手术。
在这场“打开心脏”的游戏中,还有两个重要人物。一个是明尼苏达大学的沃尔顿·李拉海(C. Walton Lillehei)。他认为可以用另一个动物(或人)充当临时心肺循环机,并称之为“交叉循环法”。多次实验后,李拉海用交叉循环法完成了45例手术,28例成功。理查德·德沃尔(Richard A. DeWall)是1954年加入李拉海团队的,之后他们制造了一台更简单、廉价的氧合器,将血液收在储存器中,氧气从底部冒上去。这个方法简单又有效。1955年5月,李拉海首次成功使用了这台机器。

李拉海使用的交叉循环法示意图

德沃尔发明的气泡型心肺机
第二个人是之前提到的科尔夫,透析机的发明者。1955年,科尔夫也加入到心肺机的游戏中。他在制造肾透析机时就意识到,血液通过玻璃纸膜后颜色似乎会变得浅一些。他突然想到,如果用高压氧气包围玻璃纸膜,氧气就会扩散进去和血细胞结合。他在克利夫兰和其他人一起完善了这个装置,并称之为膜氧合器。
之后的十几年里,这几台机器被频繁应用于心脏手术,外科医生们操作得越来越熟练。能够稳定得打开胸腔,为心脏做手术,是实现心脏移植不可或缺的重要前提。
心脏移植
世界首例心脏移植手术的施行者是南非医生克里斯蒂安·巴纳德(Christiaan Barnard),但真正的“心脏移植之父”是诺曼·萨姆威(Norman Shumway)。这两个人都在明尼苏达大学接受过医学训练。
1955年,巴纳德从南非来到明尼苏达大学进修。起初他被安排做食道研究,但他很快被隔壁李拉海实验室的心肺旁路机吸引了。他向当时的外科主任万根斯汀申请转到心脏外科研究,并成功在两年之内完成了原本需要六年的完整医学训练,包括掌握两门外语、两年的临床训练以及做实验和写毕业论文。1957年,巴纳德回到南非,带着一台万根斯汀送他的德沃尔-李拉海气泡氧合器。他迅速组建了一支心脏外科队伍,并用这台机器做了一些手术。1966年,巴纳德在一次医学培训中认识了戴维·休姆(首例肾移植的布莱根医院的医生),休姆的团队刚刚吸收了萨姆威的门生理查德·罗尔,罗尔之前已经跟着萨姆威的团队在实验狗身上进行了十年的心脏移植研究,包括手术、术后护理、免疫抑制和排斥。在这次医学培训中,巴纳德学习了肾移植的技术,还参观了罗尔的实验室,巴纳德惊讶于罗尔在狗身上做心脏移植的娴熟,更震惊于他还没有尝试过人体移植。这次医学培训结束后,巴纳德全身心投入到心脏移植中,并且暗暗觉得自己有机会成为第一个成功的人——美国当时还没有通过脑死亡的定义,但这对巴纳德来说并不是问题,在南非,只要两名医生宣告患者死亡即为法律上有效的死亡。
1967年12月3日,巴纳德迎来了机会。一位24岁的年轻女性在车祸中严重受伤,头部着地,送到医院时已经脑死亡,她的家人同意用她的心脏拯救一个本会死亡的严重心脏病患者。在手术室里,巴纳德依次取出捐献者的心脏、移除接受者的心脏、把移植心脏放入接受者的胸腔里。相比接受者因常年受心脏病所累而变得十分肿大的心脏,捐献者的心脏显得小巧而孤独。一切连接完毕,移植心脏恢复供血,慢慢变为漂亮的粉红色,开始作纤维性颤动。进行了三次药物调整后,心脏的跳动逐渐恢复稳定,他们长舒一口气,撤下了心肺机。手术成功了。巴纳德的名字也传遍了全世界。1968年1月2日,巴纳德又施行了第二例心脏移植,也获得了成功。

首位接受心脏移植的路易斯·沃什坎斯基(Louis Waskhansky)对巴纳德表示感谢。
肾移植的成功为器官移植带来了无限的希望,而心脏移植引发了全世界的兴奋。1968年,全世界有26个国家完成了101次移植。每家大医院都希望开设移植项目,世界各地的知名心外科医生都加入这一潮流中。但由于成功率和长期存活率太低,一连串的失败对器官移植产生了恶劣影响,医生们自主叫停了心脏移植。1971年,全世界只进行了17例心脏移植。
要提高移植手术的存活率,改善手术结局,还有一个大问题需要解决:排斥。
4
带移植走出黑暗的免疫抑制剂
对于接受器官移植的受体来说,移植器官是“外来物”,移植后,免疫系统会迅速识别并攻击移植器官,导致移植器官坏死、凋落,难以长期存活。
20世纪40年代,彼得·梅达沃爵士(Sir Peter Medavar)和同事在格拉斯哥皇家医院对一名严重烧伤的女性进行救助的过程中发现,用他人(志愿者)的皮肤进行烧伤部分覆盖时,受助者皮肤周围有大量免疫系统的淋巴细胞和白细胞浸润,且再次移植的时候表现出了更加迅速、强烈的排斥反应。

彼得·梅达沃爵士(Sir Peter Medavar)。
之后梅达沃在实验室研究中发现了“获得性免疫耐受”(acquired immunological tolerance)。他发现,如果向怀孕母鼠的胚胎注射非免疫匹配供体(也就是基因型不同的小鼠)的细胞,那么受体小鼠(也就是接受了细胞注射的胚胎)出生长大后,可以接受与供体同一基因型的小鼠的皮肤移植而不产生排斥反应,不需要任何药物阻断免疫反应。换句话说,受体小鼠对供体“耐受”了。然而,这一研究成果难以应用于人类治疗中。
1958年,梅达沃在牛津的一次讲座中,台下一名叫罗伊·卡恩(Roy Calne)的医学生对这个问题产生了兴趣。他去翻阅资料,看到了《自然》上的一篇文章报告了对兔子使用6-巯基嘌呤(6-MP)来抑制兔子对人类血清产生的免疫反应。
卡恩决定在接受肾移植的狗的身上试验一下,结果奏效了。1960年,他把自己的主要发现发表在了《柳叶刀》上,这是第一例用化学免疫抑制剂延长大型动物的移植肾存活时间的报告。这份报告使卡恩获得了移植界的认可,并在梅达沃的推荐下,加入了布莱根医院默里的实验室。在默里实验室,卡恩和默里从二十多种化学物中选定了硫唑嘌呤作为抗排斥药物。

罗伊·卡恩(Roy Calne)。
但不论是辐射还是类固醇、硫唑嘌呤,对免疫排斥的抑制作用都有限,还很可能对接受者带来巨大的身体伤害。到20世纪70年代后期,肾移植的一年期存活率不超过50%,急需一种高效的免疫抑制剂带移植结果走出黑暗。
瑞士制药公司山度士(Sandoz,后来被诺华公司合并)于1958年开始就设立了一个项目,安排因出差或休假而去旅行的员工收集各地的土壤样本,以筛选出最有可能具有免疫抑制性或抗癌性的真菌代谢物。
1972年1月21日,一名在挪威休假的员工采集的24-556号样本表现出明显的免疫抑制能力。接下来的几年里,山度士不断纯化、研究这个样本(由于它是环状结构,并且来源于真菌孢子,因此后来将该样本命名为环孢素A),证实了它尤为显著的免疫抑制特性。

可产生环孢菌素的tolypocladium inflatum的电镜照片。
1977 年,卡恩参加了英国免疫协会的免疫学家戴维·怀特的一次演讲。在讨论环节,山度士的博尔博士介绍了环孢素A,给卡恩和怀特留下了深刻的印象。卡恩要到了一些环孢素A,动物实验结果显示它具有异常好的抗排斥效果。在卡恩的说服下,山度士高层决定“出于人道主义”而生产环孢素。
1978年开始,移植界用环孢素进行了许多器官移植,开始的结果并不如人意,但环孢素和类固醇的联合使用表现出了良好的效果。1979年12月到1980年9月,首例肝移植的实施者托马斯·斯塔兹(Thomas Starzl)在一项非随机试验中治疗了66名患者。1981年,他又对65名肾移植患者使用了泼尼松—环孢素联合治疗。结果完全是阳性的,移植物的一年存活率为90%。到1983年,环孢素已通过FDA(美国食品药品监督管理局)的批准,可用于肾、肝和心脏移植。

托马斯·斯塔兹(Thomas Starzl)。
这种药物的发现使器官移植领域向前跨越了一大步,其重要意义也许不亚于20世纪60年代时各类移植的首次成功。移植的时代已经来临。
5
“死亡”的新标准
随着各个器官的移植手术成功,器官来源的问题日益凸显。20世纪50、60年代,当时获得器官的流程是,医生必须要等捐献者的心脏停搏,被宣告死亡(当时的死亡按照“三无”标准:没有心跳、没有血压、没有呼吸),然后获得家属的同意,再把捐献者带到手术室摘除器官(如肾脏)。这意味着在获取器官之前会等待很长一段时间,在这段时间里,器官没有血流和氧气,这段时间会对器官造成不利影响。在心脏移植实现后,这一问题就更加明显。
1966年3月9日,时任爱丁堡大学外科主任迈克尔·伍德拉夫(Michael Woodruff)认为应当组织一次会议,讨论移植中的伦理和法律问题。与会者包括默里、斯塔兹和卡恩等移植领域的领头人。
在这次会议上,默里的学生、比利时的外科医生亚历山大介绍了他们用未停止心跳的脑死亡患者的器官所做的肾移植,并详细描述了这些捐献者要满足的具体条件:无反射,无疼痛反应,平直脑电图,以及关闭呼吸机后5 分钟内无自主呼吸。虽然当时还没有用“脑死亡”的名字,但这其实已经给脑死亡下了定义。亚历山大的言论在会议上引起轩然大波和强烈反对,到会议结束,没有一个人举手支持他的观点。
其实在那个时候,外科医生已经认识到,若捐献者有心跳,器官就仍有血供和氧气,可以继续运作,直到被移出的那一刻。这样,它们在移植后立刻恢复运作的可能性会更高,移植后的运作情况也会更好。随着越来越多的器官移植获得了成功(包括肝移植和心脏移植),人们越来越迫切地需要在这个伦理问题上达成共识。
或许机会来了。
1966年,亨利·诺尔斯·比彻(Henry Knowles Beecher在《新英格兰医学杂志》上发表了一篇题为“伦理与临床研究”的文章,着重介绍了没有真正的知情同意,把受试者置于患病和死亡风险下的多个临床案例。这是最早的知情同意相关报告。
1967年9月,比彻给哈佛医学院院长罗伯特·艾伯特写信,要求他召集学校的人类研究常设委员会(Standing Committee on Human Studies)开会,讨论“无救的无意识患者造成的伦理问题”。
1967年10月19日,会议如期召开。默里在会上建议编纂一个新的死亡定义,这件事应该由哈佛来做。这样的提议受到了比彻的赞同和感谢。
1968年3月14日,人类研究常设委员会举行了第一次会议,起草了6份草案,并于1968年6月25日完成了报告。默里为报告的撰写发挥了重要作用,这3个月里,他几乎每天都在跟比彻交流。最终文件于1968年8月5日发表在了《美国医学会杂志》上,题目为“不可逆性昏迷的定义:哈佛医学院脑死亡定义特设委员会报告”。文章开篇就指出,“我们的主要目的是将不可逆性昏迷作为死亡的新标准”。作者接着从两方面讨论了这样做的重要性:第一,解决ICU内患者的无效治疗;第二,“死亡定义的过时标准会导致移植器官获取的争议”。

哈佛小组发表的“不可逆性昏迷的定义:哈佛医学院脑死亡定义特设委员会报告”。
哈佛的死亡新定义并没有立刻被人们接受,之后随着心脏移植的成功,人们对器官移植的支持度飙升;而因为缺乏高效的免疫抑制导致移植结局不佳,人们又开始抵制器官移植;之后随着技术的发展、新药物的出现,器官移植的成功率和器官存活时间逐渐上升。在这样的曲折中,前后用了十几年,公众的观点才和哈佛委员会达到一致,并接受了脑死亡的定义。
1980年,美国全部50个州的立法机构通过了《统一死亡判定法案》(Uniform Determination of Death Act),宣告脑死亡在法律上等同于死亡。这一立法对器官移植的成功至关重要。由脑死亡捐献者提供的器官数量最多、结局最好,也使得外科医生能在最可控的情况下进行器官移植。从那时起,脑死亡等同于死亡已经成为美国和大多数国家的法律,也得到了公众的接受和认同。
6
不再因等待移植而死亡
的未来有多远?
异体移植
在移植的探索之路上,人们从未把目光局限于同一物种之内。黑猩猩的基因和人类高度相似(一些研究估计有96%到99%的基因重合),基思·瑞茨玛(Keith Reemtsma)勇于尝试,在1963年把一只恒河猴的双肾移植给了一名32岁的肾衰竭妇女。虽然手术进行得很顺利,但这位妇女的身体对肾脏产生排斥,患者因无法治疗的肾衰竭而死。1964年1月,瑞茨玛为另一名女性患者移植了黑猩猩的两个肾。术后,肾功能正常,患者甚至恢复了正常的生活。移植9个月后,患者因电解质失衡(怀疑)死亡,尸检显示移植肾一切正常。

a:基思·瑞茨玛(Keith Reemtsma);b:瑞茨玛所移植的黑猩猩肾脏。
瑞茨玛的成功激励了其他人加入异种移植的队伍。世界各地进行了许多其他的尝试,可能最为著名的是“Baby Fae”的案例。1984年,出生不久的史蒂芬妮患有心衰,她在加利福尼亚的洛马林达大学医学中心接受了一颗狒狒的心脏。她活了21天,死于排斥反应。最初的治疗计划是把这颗心脏作为缓兵之计,直到找到一颗和她相容的人类心脏,但她并没有等到这颗合适的心脏。
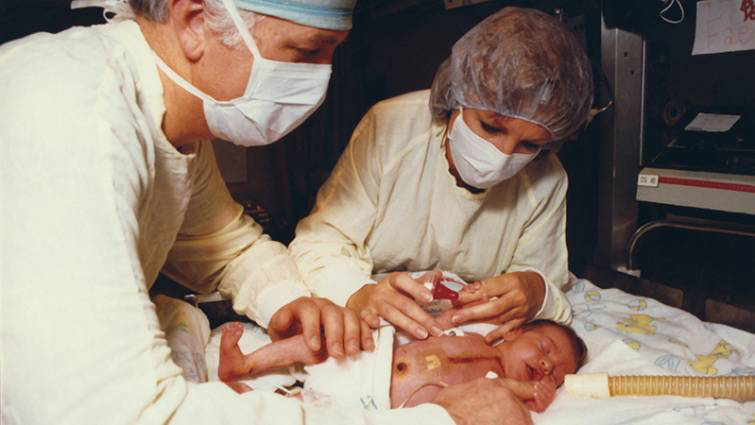
Baby Fae:史蒂芬妮(Stephanie)。
到20世纪90年代,研究人员呼吁,在对传染病的风险、复杂的知情同意(这点看起来有些奇怪,毕竟很难想象如何获得灵长类动物或猪的同意)和动物福利问题有更多讨论和理解之前,暂停临床异种移植。虽然FDA(美国食品药品监督管理局)没有正式禁止,但它明确表示,将不会批准任何人体异种移植试验。
今天,异种移植再次成为充满希望的移植未来选择,但不再考虑灵长类动物。原因有很多:很多灵长类目前是濒危保护动物;灵长类动物繁殖很慢,器官不易获取;灵长类的器官相比人的器官体型太小;灵长类动物与人的基因相似度太高,很容易引入异种病毒或其他感染。
目前在异种移植领域最“炙手可热”的动物是猪(尤其是小型猪),它们容易繁殖、体型合适,且与人类的遗传同源性较高。但由于猪的细胞表面有灵长类不具有的α-gal表位,普通的猪器官会被迅速排斥。随着基因编辑技术的发展,现在已经可以将移植器官定向修饰。2002年,研究人员克隆出了第一只无α-gal的小猪;哈佛大学的一个团队已经成功制造出了内源性逆转录病毒全失活的猪……许多研究机构和医药公司已经在这个领域投入了大量资金,也聚集起了一大批专家推进这一领域的研究,期待未来能看到更多异种移植的进展。
3D生物打印
3D生物打印技术指的是,通过CT、MRI等技术获得组织或器官的结构图像和数据后,通过计算机设计与建模,精准地将细胞、生物材料、生长因子等在三维空间上组合起来,使之形成具有生物活性,且能替代甚至超越目标组织、器官功能的结构。
这项技术可以追溯到1988年,当时德克萨斯州立大学的罗伯特·克莱伯博士(Dr. Robert J. Klebe)首次提出了自己的构想,用喷墨打印机将细胞精准定位,以构建二维和三维相结合的结构。经过几十年的发展,3D生物打印已经取得了较大进展,并应用于医学临床中。3D生物打印可以为患者量身打造最合适的组织或器官,且由于原材料中的细胞取自患者自身,因此可以避免出现免疫排斥。目前已经成功打印出了血管、皮肤、器官支架、骨骼等,利用这项技术,医生能为患者修复器官损伤,替换坏死组织。
3D打印器官是这一领域的研究者孜孜不倦想要攻克的高峰,器官的复杂结构、重要功能等特点为器官打印带来了许多技术难题和伦理问题,但研究人员从未停止尝试的脚步。国外的一些研究团队已经成功打印出了微型肝脏、心脏、肾脏等脏器,对于器官移植来说,这是充满希望的一条路。

特拉维夫大学(TAU)的一个研究团队成功用人体细胞3D打印出的心脏。
新型材料的应用
利用新型非生物材料修补和制造组织和器官,是组织修复和器官移植的另一个方向。目前发展比较成熟的是骨移植的替代材料,包括胶原、透明质酸、壳聚糖等天然高分子材料,聚氨酯、聚丙交酯、聚乙交酯、聚己内酯等合成高分子材料,多孔钛及钛合金、钛镍合金、钽金属和不锈钢等医用金属材料,氧化铝、氧化锆、羟基磷灰石、磷酸三钙等医用陶瓷材料,以及以石墨烯材料和碳纳米管为主的碳素材料及脱细胞基质材料等。这些材料各有利弊,有的具有较好的组织相容性,有的具有较高的强度和延展性等。
单一成分的人工骨的研究和应用较早,但性能完善的复合骨无疑是研究的重点和未来的方向。除了在骨移植方面的应用,将相容性生物材料用于移植器官的包裹以减少免疫排斥也是研究得较多的方向,目前已取得较大进展的包括新型材料在胰岛移植和肝细胞移植中的应用。
用新型材料进行脊柱修复。
科技的发展将移植这件事从科幻小说带到了现实中,现在又在探索更多器官来源的领域内开疆拓土。对于苦苦等待移植器官的患者来说,这些新尝试、新技术、新材料为他们带来了一个充满希望的未来。
目前,全世界每年进行几十万例器官移植手术,几十万条生命得到了延续。这些成就的背后是许多先驱者的坚持,和更多患者的奉献。在器官移植这条路上,从首例肾移植证明了器官移植实现的可能,到环孢素为移植物的存活保驾护航,再到今人对各种移植可能性的无限探索,移植先驱们把黑暗中的闪光收集起来,用非凡的勇气和不懈的努力摸索出了一条光明的道路,把无数器官捐献者的死亡化作了移植接受者的重生。
或许,支撑着一代代“移植人”坚持下去的,正如首例器官移植实施者默里所说,“我从没有气馁过,如果我们放弃了,病人就没有希望了……”
参考文献:
1.Peter Crittendon.Ending a Historical Taboo.[DB/OL]. https://www.amren.com/news/2010/03/ending_a_histor_1/
2.Alexandrea P.Is 3D bioprinting the future of tailor-made medicine?.[DB/OL].https://www.kidneynews.org/kidney-news/features/willem-kolff-honoring-pioneer-of-modern-dialysis.2019-11-07
3.Willem Kolff: Honoring a pioneer of modern dialysis.[DB/OL].https://www.kidneynews.org/kidney-news/features/willem-kolff-honoring-pioneer-of-modern-dialysis.
4.Larry Kidder.Stephanie’s Heart: The Story of Baby Fae.[DB/OL].https://news.llu.edu/patient-care/stephanie-s-heart-story-of-baby-fae.2016-09-08
5.Henry T. Tribe, The discovery and development of cyclosporin, Mycologist, Volume 12, Issue 1, 1998, Pages 20-22, ISSN 0269-915X, https://doi.org/10.1016/S0269-915X(98)80100-6
6.Stoney, W. S. (2009). Evolution of Cardiopulmonary Bypass. Circulation, 119(21), 2844–2853. doi:10.1161/circulationaha.108.830174
7.Fricker, J. (2017). Thomas Starzl. BMJ, j1806. doi:10.1136/bmj.j1806
8.A Definition of Irreversible Coma.(1968). JAMA, 205(6), 337. doi:10.1001/jama.1968.03140320031009
9.Renal xenotransplantation: experimental progress and clinical prospects.https://doi.org/10.1016/j.kint.2016.08.035
10.闫志文,李硕峰,李傲,张帆,赵文迪,李静怡,黄东铭,李思奇,孙红.3D生物打印技术在组织工程和器官移植中应用的研究进展[J].吉林大学学报(医学版),2019,45(01):197-201.
11.魏晨旭,何怡文,王聃,侯婧霞,谢辉,殷放宙,陈志鹏,李伟东.组织工程学中骨修复材料的研究热点与进展[J].中国组织工程研究,2020,24(10):1615-1621.
12.孙振,潘庆杰,朱丰龙,王红军,董晓.胰岛移植的应用及新方法[J].中国细胞生物学学报,2015,37(12):1679-1684.
13.蔡鸿宇,陈钟.肝细胞移植免疫排斥反应的研究与应用[J].中国组织工程研究与临床康复,2007(47):9538-9542.


