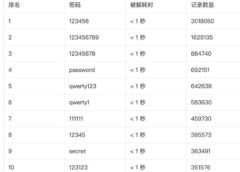
9月12日,澎湃新闻(www.thepaper.cn)从牛津大学疫苗研发团队处获悉,该团队与英国药企阿斯利康(AstraZeneca)合作研发的新冠疫苗已重新恢复临床试验。

4天前,该款疫苗的三期临床试验因注射疫苗的志愿者出现“无法解释”的疾病而暂停。
牛津大学疫苗团队向澎湃新闻发送邮件称,该款新冠疫苗的随机对照临床试验将在英国所有临床试验地点继续进行。
“作为试验的一部分,全球约有1.8万人接种了该款研究疫苗。在这样的大型试验中,预计会有一些参与者出现不适,必须对每个病例进行仔细评估,以确保对疫苗安全性进行仔细评估。”
牛津大学疫苗团队表示,目前关于该款疫苗的独立审查过程已经结束,根据独立安全审查委员会和英国监管机构MHRA的建议,试验将在英国重新开始。
不过该团队告诉澎湃新闻,出于对参与者保密原则,不能透露有关该病例的医疗信息。
“我们承诺在我们的研究中保证参与者的安全和最高的行为标准,并将继续密切监控安全。”
当地时间9月8日,阿斯利康暂停了其与牛津大学合作研发的新冠病毒疫苗临床试验,原因是一名英国志愿者患有“无法解释”的疾病。
阿斯利康和牛津疫苗团队在9日回复澎湃新闻的邮件中均强调,此次暂停临床试验的举动,是疫苗试验中的标准审查程序,旨在确保试验性疫苗不会引起志愿者的严重反应。
阿斯利康疫苗的推进时间表
阿斯利康的疫苗是一款基于转录缺陷的腺病毒载体的疫苗。该病毒能在黑猩猩中引起感染,并包含新冠(SARS-CoV-2)病毒棘突蛋白的遗传物质。人接种疫苗后,病毒会产生表面刺突蛋白并诱导免疫反应,如果后来接种者感染新冠病毒,免疫系统则会被激发来攻击病毒。
4 月 30 日,阿斯利康在官网宣布将和牛津大学合作研发出改款疫苗。同时宣布疫苗已于 4 月 23 日进入临床 I 期试验。I 期试验在南英格兰地区的 5 个试验中心进行,共纳入 1077 名 18~55 岁的健康志愿者,以测试疫苗的安全性和有效性。
6 月底,阿斯利康宣布在巴西和南非开展 I/II 期试验。
7 月 20 日,该疫苗的 I/II 期揭盲结果发布在柳叶刀杂志。
同日,阿斯利康在官网宣布 I/II 期试验结果良好:所有的受试者都能耐受疫苗,并能在体内诱导针对新冠病毒棘突蛋白的抗体。疫苗组的志愿者,在第一剂疫苗 14 天后达到 T 细胞免疫反应的峰值,并在注射后 8 周依然维持免疫应答反应。
接种疫苗一个月后 91% 的疫苗组志愿者和接受第二剂的 100% 疫苗组志愿者都检测到了针对新冠病毒的活性中和抗体。
I/II 期试验中并没有发现严重的副反应,常见的疫苗副反应仅包括注射部位疼痛、发热感、寒颤、肌肉疼痛、头痛和疲乏。这些副反应能通过提前给予扑热息痛而减少。
8 月 31 日阿斯利康公司在官网宣布开始在美国进行 III 期试验,将入组 30000 名 18 岁以上的成年人,以验证疫苗的安全性、有效性及免疫原性。
9 月 3 日阿斯利康官网对当前该疫苗的临床试验进度进行了盘点:目前临床试验包括了在美国展开的 III 期试验、在英国和巴西进行的 I/II 期试验的后期临床试验、在南非进行的 I/II 期临床试验。阿斯利康还有近期在日本、俄罗斯开展临床试验的计划。这些试验总计将从全球各地纳入 50000 名志愿者。
9 月 8 日,临床试验因接种者出现严重不良反应而暂停。
9 月 12 日,据报道,阿斯利康公司该款疫苗的临床试验重启。
其他新冠疫苗研发的进度
根据 WHO 的疫苗研发跟踪列表显示,目前共有 35 款疫苗已经进入了临床试验的阶段,另有 145 款疫苗还处于实验室研发的阶段。
除了近期陷入试验中断风波的来自阿斯利康公司的疫苗( AZD1222 )之外,还有另外 8 款疫苗目前进入了临床试验的 III 期,其中 4 款来自我国,包括陈薇院士团队领衔的军事医学研究院和康希诺生物联合开发的疫苗、医科院和科兴生物联合研制的疫苗、以及国药集团和中疾控病毒所研制的疫苗(共 2 款,分别由北京及武汉生物制品研究所研发)。
其余处于临床试验 III 期的疫苗分别来自于加马利亚研究所(Gamaleya Research Institute)、杨森制药(Janssen)、Moderna公司和辉瑞公司。
临床试验被中断,不一定是坏消息
根据麻省理工学院斯隆管理学院 2018 年发表在 Biostatistics 的文章,每年仅 14% 的药物通过了所有的临床试验,并最终通过了相关部门的审核准许上市。
这个 14%,「已经比想象中的高得多(much higher than previous studies indicate)」。
相比肿瘤相关药物 3.4% 可怜的通过率,疫苗产品其实已经以 33.4% 的通过率傲视群雄。
2015 年发表在 BioRxiv 上的一篇文章更是详细地分析了临床试验研发中断的具体原因,包括但不限于这药不管用(缺乏有效性)、这药有毒(安全性存疑)、公司不干了/没钱了(资金链断裂或公司决策因素)、没这么多志愿者来完成临床试验(试验样本不足),等等……
其中,因为药品安全性原因试验被迫中断的情况,占了 6.2%。
例如默克公司曾推出一款用来预防金黄色葡萄球菌感染的疫苗 V710。II 期试验在 206 名长期透析病人中进行试验,分 3 针于第 1、28、180 天注射。II 期试验的效果非常好:抗体在第 2 次注射时就能在志愿者血液中检测到,并能在志愿者体内持续 1 年。
带着优秀的 II 期试验结果,V710 疫苗昂首挺胸开始了在 26 个国家的 8000 名志愿者身上进行的 III 期试验。这些志愿者均为接受心脏或肺部手术的患者。
令人唏嘘的是,V710 疫苗的 III 期试验结果却遭遇滑铁卢。揭盲结果显示这款疫苗病不仅不能让病人免遭金葡菌感染,还导致了更多的多器官衰竭,甚至死亡病例的发生。
FDA 的高级专员 Stephen Hahn 在 9 月 10 日时针对阿斯利康疫苗试验中断事件提到:「我们都知道时间紧迫。我们都想要一款能够立即上市的疫苗,但我们更希望这是一款安全的疫苗。」
正如那句欧美的谚语:「安全总比抱歉好。(Better safe than sorry.)」(审核:gyouza)